
 |
|
|
Главная Переработка нефти и газа Параметры и физические свойства сухого воздуха g зависимости от температуры при давлении р 10* н/л- [1 кГ см] Таблици 2
Величина коэффициента A от давления практически не зависит. Теплоемкость (удельная теплота, удельная теплоемкость) равна количеству теплоты, которое необходимо сообщить единице количества воздуха (кмолю, кг, м) при нормальных условиях, чтобы изменить его температуру на ГС. Различают следующие теплоемкости: молярная (мольная) Мс в дж1{кмоль-град) [ккал/{кмоль-град)]; массовая с в дж/(кг-град) [ккал!{кг-град)]; объемная (отнесенная к нормальным условиям) с в дж1{м1град) [ккал/{мУград) ]. Зависимость между различными теплоемкостями определяется следующими равенствами: ~ Ж (кс-граб) [ккал/{кг-град)]\ Сн = дж/{А1-град) [ккал/{л-град)]; Сн = «бн дж1{м-град) [ккал/(м-ерад)], 1,29-10» 1,29-10» 1,29-10» 1,29 1,29 1,29 1.29 1,29 1,29 1,29 1,3 1,31 1,31 ,32 1,33 10» 10» 10» 10» 10» 103 10» 10» 10» 10» 10» 10» 1,35-10» 1,36-10» 1,38-10» 1,41-10» 1,43-10» 1,46-10» 0,1.38 0.128 0,123 0,119 0,115 0,111 0,108 0,105 0,101 0,098 0,096 0,093 0,074 0,061 0,052 0,045 0,040 0,032 0,027 0,024 0,020 1,65 1,75 1,80 1,85 1,90 1,95 2,00 2,05 2,10 2,14 2,19 2,23 -,65 3,03 3,37 3,69 3,98 4,52 5,00 5,44 6,10 1,96 2,10 2,16 2,22 2,28 2,34 2,40 2,46 3,51 2,57 2,63 2,68 3,22 3,76 4,22 4,69 5,14 6,02 6,74 7,45 8,40 6,94 6 94 6,94 6,94 6,94 6,94 6,95 6,95 6,95 6.95 6,96 6,96 7,00 7,05 7,12 7,19 7,26 7,41 7,55 7.67 7,83 0.24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,241 0,242 0,243 0,246 0,248 0.251 0,256 0,261 0,265 0,2/0 0,31 0,31 0,31 0,31 0,31 0,31 0,31 0.31 0,31 0.31 0,31 0,311 0,312 0.315 0,318 0,321 0,324 0,331 0,337 0,342 0,350 где Q„ = 1,293 кг/м - плотность воздуха при нормальных условиях, т. е. при О" С и 760 мм рт. ст. Поскольку тепло подводится либо при постоянном давлении (фиг. 1, а), либо при постоянном объеме (фиг. 1, б), каждая ИЗ теплоемкостей имеет два значения: теплоемкость при постоянном объеме Л1с„ с„ с; теплоемкость при постоянном давлении мср, Ср, с;„. Для нагрева при постоянном объеме теплота расходуется только на изменение внутренней энергии, т. е. на повышение его температуры. Нагрев при постоянном давлении сопровождается также совершением внешней работы. Существуют следующие равенства: р~~с- = R дж/{кг• град); [Ср~с, = AR ккал/{кг• град)], где R - газовая посгоянная; для воздуха R 287 дж/{кг-град), ИЛИ R = 29,3 кГм1(кг-град); Л = кшл/кГм -lenioBOH эквивалент работы. 2 Карабин 17 Приближенные Значения молярных теплоемкостей: Мср 29,33.103 дж/{кмоль • град); Мс .-s 21 • 10 дж/{/шоль град); МСр7 ктл1(кмоль• град); Мс. 5 лка-г (кмоль-град). Разность теплоемкостей: Мср-Мс 8,36-10 дж,{кмоль-град). :2 ккал!{кмоль-град). Отношение теплоемкостей при постоянном давлении и постоянном объеме k - называется показателем степени адиабатного про- Цесса: 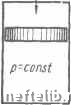 Мср Ср р. « v-const Фиг. 1. Способы тепла: сообщения а-при постоянном давлении; 6-при постоянном объеме. Для воздуха и двухатомных газов k 1,4. С повышением температуры теплоемкость воздуха несколько возрастает, вследствие чего различают истинную теплоемкость dt и имеющую практическое значение среднюю теплоемкость с - где q - количество тепла, сообщенного единице количества воздуха при изменении его температуры от до t.2 (табл. 2). В зависимости от температуры и давле-5. Основные законы ния воздух может находиться в трех агре-и уравнения гатных состояниях: твердом, жидком и газообразном. Критическая точка для воздуха соответствует давлению рр = 38,4 ата (38-10 н/лг) и температуре Гр= 132,6 °К (4р = -140,6°С). При температуре выше 4р -140,6" С воздух может находиться только в газообразном состоянии независимо от давления. При атмосферном давлении состояние насыщения (сжижения) воздуха наступает при L -193" С. Преимущественное состояние воздуха - газообразное, далеко от насыщения. В этом случае для воздуха практически применяют законы идеальных газов, т. е. таких газов, в которых пренебрегают объемом молекул и силами сцепления между ними. Законы идеальных газов. Закон Бойля-Мариотта: при постоянной температуре (Г = con.st) справедливо равенство pv = con.st, где р и v - давление и удельный объем. Закон Гей-Люссака: при /; = const имеют место равенства у- = const и qT - const. Уравнение состояния (характеристическое уравнение, уравнение Клапейрона- Менделеева, обобщающее законы Бойля-Мариотта и Гей-Люссака): для 1 кг pv = RT; для т кг pV = mRT дж, где R - газовая постоянная, представляющая собой работу изобарного изменения состояния 1 кг газа при изменении температуры на 1°С; для сухого воздуха R = 287 дж1{кг-град) [R --= = 29,27 кГм/{кГ-град)]. Закон Авогадро: при равных условиях (одинаковые р и Т") в равных объемах любых газов содержится одно и то же число молекул, отсюда = idem, где М - молекулярная масса, называемая киломолем (кмоль) и представляющая собой единицу измерения в кг такого количества газа, сколько единиц в его молекулярной массе, т. е. кмоль - это М кг газа; например для кислорода Мо, = 32 кг/кмоль, для водорода AIb, = 2 кг/кмоль и т. д. При нормальных условиях (О" С и 760 мм рт. cm) объем 1 моля любого газа имеет определенную величину: Mv = 22,4 мкмоль; отсюда 22.4 М м/кг Qh = 22,4 кг/м. Из уравнения состояния для 1 моля вытекает уравнение универсальной газовой постоянной (отнесенной к 1 молю): MR = 8314 дж1 {кмоль-град) [М/? = 848 кГм/{кмоль-град)]. что дает возможность легко определить газовую постоянную любого газа. Например, для кислорода 1 = = 260 дэ1с/{кг-град) [Я = 26,5 кГм/{кГ-град)] ; для водорода 8314 j4\57 д ж/{кг-град) I/? = = 424 кГм1{кГ-град) Закон Дальтона - закон газовых смесей: 1. При отсутствии химических реакций каждый из газов, входящих в смесь, занимает объем, равный объему всей смеси, и развивает так называемое парциальное давление, соответствующее его объемной составляющей, т. е. тому объему, который занимал бы составляющий газ при давлении всей смеси. 2. Сумма парциальных давлений равна давлению всей смеси: Рсм= Pi- в приближенных практических расчетах воздух рассматривают как смесь кислорода Og и азота Nj. Округленные значения величин, характеризующих сухой воздух: массовые составляющие go = 0,23, = 0,77; объемные составляющие Го, = 0,21, г = 0,79; плотность и удельный объем при нормальных условиях Q„ = 1,293 кг/м, = 0,773 м/кг; средняя молекулярная масса /Ие = 28,95 кг/моль; газовая постоянная R = 287 дэ!с/{кг-град) IR 28,27 кГм/{кГ-град)]; парциальные давления при ре,: = 1 от ро = 0,21 am, Pn, 0,79 am. Первый закон термодинамики. Основное уравнение термодинамики: подведенная извне теплота q расходуется на приращение внутренней энергии и и на преобразование во внешнюю работу /: q - Аи + I дж/кг; Iq Аи + Al ккал/кг]. При больших скоростях необходимо учесть также изменение кинетической энергии тела при изменении скорости от до Cg. Основное уравнение термодинамики принимает следующий вид: 2 д2 q = Au + l + -- = i -f - дж/кг; q = Аи + Al-\-А - ккал/кг Первый закон термодинамики - закон сохранения энергии, закон невозможности получения вечного двигателя (perpetuum mobile), закон эквивалентности теплоты и работы. Преобразование теплоты в работу и наоборот совершается по закону эквивалентных соотношений Q = L, дж. (По системе единиц МКГСС Q = AL а L = EQ, где Л и £ - постоянные эквиваленты; А = ккал/кГм - тепловой эквивалент работы; Е = 427 кГм/ккал ~ механический эквивалент тепла.) Килограмм-калорией или килокалорией называется количество теплоты, необходимое для нагревания 1 кг воды на Г С (точнее от 19,5 до 20,5° С - ОСТ 6259). Мощностью называется работа в единицу времени N - ~ вт; I вт = \дж/сек. Применяются также единицы мощности - лошадиная сила (л. с.) и 1 киловатт {кет); \ л.с. = 75 кГм/сек; 1 кет = 102 кГм/сек; 1 кет = 1,36 л. с. и I л. с. - 0,736 кет. Наряду с кГм применяются более крупные единицы измерения энергии (работы)-лошадиная сила-час {л.с-ч] и киловатт-час (квт-ч). Соответствующие тепловые эквиваленты: 1 л.с.ч= iT 632 ккал - 2,65- 10«бж ; 1 квт-ч =г 102-3600 860 ккал = 3,6-10 дж. Второй закон термодинамики объясняет условия возможности преобразования тепловой энергии в механическую. Если работу трения, торможения или сжатия можно полностью преобразовать в теплоту, то обратный процесс возможен лишь частично, при определенных условиях, которые определяются вторым законом термодинамики. Наиболее существенные формулировки второго закона термодинамики: 1. Для возможности перехода теплоты в работу необходим температурный перепад, т. е. наличие источника с высокой температурой (верхний источник) и источника с более низкой температурой (нижний источник). 2. Для возможности перехода теплоты от холодного тела к теплому необходима .затрата работы извне. 3. Нет машины, которая всю подведенную теплоту qi преобразовала бы в работу (невозможность perpetuum mobile второго рода). Только часть подведенной теплоты может быть преобразована в работу (в эквивалентных количествах, установленных первым законом термодинамики), а часть q подведенной теплоты осязательно уйдет в нижний источник тепла без преобразования в работу. 0 1 [ 2 ] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |