
 |
|
|
Главная Переработка нефти и газа Методы исспедования кинетики реакций. Кинетические законы устанавливаются при изучении воздействия каждого параметра, например, концщтрации реагентов, температуры, а также изменения скорости расхода какого-либо реагшта или скорости образования какого-либо продукта реакции. JIflK определения, хотя бы качественного, скорости реакции применяют методы дифференциалыюго термического анализа (ДТА), базирующиеся на тепловом эффекте некоторых реакций. Аппаратура для ДГА состоит из двух идентичных тиглей, в один из которых помещают небольшое количество исследуемого реагента, в другой - эталонное соединение. Оба вещества нагревают в присутствии участвующего в реакции компонента (при окислении - в присутствии кислорода). Разность температур в двух тиглях позволяет судить о течении реакции. Совместное использование термогравиметрического анализа (ТГА), состоящего в определении изменшия массы реагента при повышении температуры, и анализа отходящих газов (АОГ) в тех же условиях, позволяет изучать скорости химических превращений некоторых веществ в зависимости от температуры. 2.2.3. Пиролиз углеводородов Химические превращения углеводородов при нагревании называются пиролизом. При пиролизе протекают реакции трех видов: дегидрогши-зация, крекинг и конденсация. Для дегидрогшизации число связанных атомов углерода в реагирующих молекулах не изменяется; при крекинге происходят разрыв связей и образование молекул с более короткой цепочкой, чем исходные; при конденсации образуются соединения с большим числом атомов углерода, чем исходные. Характер и скорость реакций при пиролизе зависят в основном от химической структуры углеводородов и температуры. Пиролиз парафинов (алканов). Парафины - вещества,формула которых в общем виде может быть записана как С„Н„. , разлагаются при температуре от 400 до 700 °С, причем существуют два варианта этого процесса: дегидрогенизаюи с.н,„+, i=r c.h,.-f н, [дн»29 ккал/моль]; крекинг го = шн«(........;. - c.hsu ьс„.н„„, [ahis ккал/моль]. Первая из этих эндотермических реакций обратима. Энергия активации реакции дегидрогенизации вьшю, чем крекинга (соответственно 70 и 50 ккал). Дегидрогенизации обычно подвергаются углеводороды с короткой молекулярной цепочкой (от метана СН4 до бутана саню) начиная же с пентана CsHij для парафинов более характерен процесс 66 крекинга. Осуществить дегццрогшизащио легче при наличии разветвленной молекулярной цат, так как знергия связи С-Н убьшает от первичного к третичному атому углерода R-CH, более стабилен, вторичный углеродный атом более стабилен, RA: H третичный углеродный атом углеродный атом Разнообразие продуктов пиролиза возрастает при удлинении моле-купяриш цепочки, так как увеличивается число С-С и С-Н связей; увепичивается оно и с повьшюнием температуры вследствие того, что становится возможным все большее количество химических реакций. При температурах выше 400-500 °С вследствие поликонденсации процесс дегидрогшизации может привести к образованию ароматических углеводородов твердого углеродного осадка. Пиролиз ароматических соединений. Ароматические углеводороды являются производными бензольного ряда. Бензольное кольцо очень стабильно. Прн нагревании в первую очередь ослабевают связи С-Н, разрупюние С-С связей приводит к разрушению кольца. Для аро-магических соединогай более характерны реакции конденсации, а не дегидрогенизации. Так, при нагревании бензола до 700-8GiO °С получаем •<0> -> <0>-<0> +н.. с.Н. (с.Н,), Далее образуются конденсированные соединшия с несколькими бензольными ядрами, такими,как: нафталин ! I Г) антрацен 1 Q \ ] Q ; CioHg; фенантро! ( 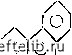 СмНю, а также макромолекулы со структурой, аналогичной структуре графита. Реакционная способность сложных ароматических соединений зависит от свойств ядра и заместителей. Пиролиз нафтенов (цикланов). Цикланы - это углеводороды, состоящие из насыщенных циклов, например циклогексан сн, сн, сн, сн. \сн/ Атомы водорода в них могут &1ть замещены, например, на алкиль-ныецепиС„Н,„+ При нагревании часто происходят разрыв колыша циклана и образование линейной молекулы олефина. Иногда кольцевая молекула циклана превращается в бензольное кольцо, так как ароматические соединения при повьпиенных температурах значительно стабильнее нафтенов. Стабильность нафтенов сравнима со стабильностью парафинов. 2J2A. Окисление углеводородов Углеводороды подвержены окислению. К классическим окислителям относится кислород воздуха, но существуют и другие окислители: газообразные (азот . . .), жидкие (перекиси, азотная кислота) и даже твердые (перхлораты). При окислении углеводородов можно получить широкий спектр продуктов реакции. В некоторых случаях углеводородные цепи разрушаются полностью, углерод связывается с образованием СОз или СО, а водород - с образованием НзО - тогда говорят о сгорании углеводорода. В других случаях углеводородная цепочка сохраняется, но в молекулу внедряются атомы кислорода. Рассматривая варианты образования связи атомов кислорода и углерода в молекуле углеводорода, получим следующие основные типы реакций сгорания и окисления [2.18] : 1) полное сгорание (до получоош СОз иНзО) R-(t -r4--О, RR + CO, + H,0; i (- 2) неполное сгорание (цо получения СО и Из О) К-С -R-l О. -у RR-J-CO-f-H,0; Н (2.26) 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 [ 20 ] 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 |
||
 |
 |