
 |
|
|
Главная Переработка нефти и газа Глава 5 ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ МАГИСТРАЛЬНЫХ ГАЗОПРОВОДОВ 5.1. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ И СВОЙСТВА ГАЗОВ Количество газа, как и любого другого вещества, естественно выражать в единицах массы. Однако принято определять не массу газа, а его объем, приведенный к стандартным условиям. Стандартные условия-это давление, равное 0,1013 МПа, и температура 293 К (20 °С). Не следует путать стандартные условия с нормальными, (0,1013 МПа и 273 К). Расход газа выражают как в единицах массы, так и в единицах объема. Массовый расход, если нет путевых отборов или подкачек, не изменяется по длине газопровода. Объемный расход возрастает, так как давление по длине газопровода снижается. Объемный расход на входе в газоперекачивающий агрегат, т. е. при условиях всасывания, называют объемной подачей. Объемный расход, приведенный к стандартным условиям, называют коммерческим. Коммерческий расход - аналог массового; по длине газопровода он остается неизменным. Плотность газа р зависит от давления и температуры. Поэтому данные о плотности должны сопровождаться указанием условий (давление и температура). Однако, когда речь идет о плотности при стандартных условиях, указание на эти условия часто опускают. Удельный объем - величина, обратная плотности: v = 1/р, Часто пользуются относительной плотностью газа по воздуху А = = р/рвоэд. Вязкость газа - свойство, являющееся причиной внутреннего трения, а следовательно, и сопротивления при движении в трубопроводе. Вязкость газа динамическая определяется главным образом количеством движения, переносимым молекулами при переходе их из одного слоя в другой. При увеличении температуры возрастает скорость движения молекул и, следовательно, переносимое количество движения. Поэтому при повышении температуры вязкость возрастает. Зависимость динамической вязкости т] от температуры Т описывается формулой Сатерленда т) т1о(Г/273)5(273 + С)/(Г+ С), где то- вязкость при 273 К; С - постоянная величина. Теплоемкость (массовая удельная) есть количество тепла, необходимое для нагревания единицы массы газа на один градус: с = = dqIdT. Теплоемкость зависит от природы газа и от происходящего процесса. Если газ нагревается изохорически, то подводимое тепло q идет на увеличение внутренней энергии и; теплоемкость при постоянном объеме с = dqIdT = duldT. Если же газ нагревается изобарически, то подводимое тепло идет также и на совершение работы; теплоемкость при постоянном давлении d(u + pv) di " dT dT dT функция L = и + pv называется энтальпией. Эффект Джоуля - Томсона - это изменение температуры реального газа при дросселировании. Дросселированием в газопроводе можно считать распределенное по длине падение давления. При обычных для газопроводов давлении и температуре дросселирование сопровождается охлаждением газа. Снижение температуры газа при движении его по трубопроводу из-за эффекта Джоуля - Томсона можно объяснить так. Считается, что дроссельный процесс энергетически изолирован. В этом случае внутренняя энергия остается неизменной. Внутренняя энергия включает в себя кинетическую энергию молекул и потенциальную энергию их взаимодействия. Газ при движении по газопроводу расширяется. В результате увеличивается расстояние между молекулами и, следовательно, возрастает потенциальная энергия их взаимного притяжения. Но поскольку внутренняя энергия, как было сказано, остается неизменной, увеличение потенциальной энергии сопровождается уменьшением кинетической энергии молекул, т. е. снижением температуры газа. Эффект снижения температуры газа при дросселировании характеризуется коэффициентом Джоуля-Томсона Di = (dT/dp)i. Газовые смеси. Любой природный газ - смесь газов. Состав смеси может быть выражен в объемных, мольных и массовых долях. Объемная, мольная и массовая концентрации г-го компонента в смеси будут соответственно У; =- у[ = Л/,/2Л/,; (/; = /П;/2/П;, здесь К; - объем г-го компонента; - число молей в объеме Vi; т - масса г-го компонента. Учитывая, что Vi/Ni, т. е. объем одного моля, согласно закону Авогадро, для всех газов одинаковый, из выражений для Vi и yi находим, что yl = Vi, т. е. мольные и объемные концентрации совпадают. Связь между мольной (объемной) и массовой концентрациями найдем из очевидных равенств: /П; = цЛ/; и Sm; = р2Лг, где - молекулярная масса г-го компонента; fx - молекулярная масса газовой смеси. Разделив первое равенство на второе, получим У1 = (цУц) yi. Отсюда, если учесть, что 2г/; - 1, получается формула для определения молекулярной массы газовой смеси: ц = 2«/ipi или, поскольку yi = Vi, \i = 2u;p,;. Уравнение состояния. Состояние газа определяется зависимостью между давлением р, объемом V и температурой Т. Графически эта зависимость может быть изображена семейством изотерм (рис. 5.1). Линии ТА (TiAi, ТА и т. д.) показывают изотермическое сжатие в газовой фазе. По достижении объема начинается конденсация. Горизонтальные участки AiEy, Аф., характеризуют двухфазное состояние. В точках fii, Б2 конденсация заканчивается; очень крутые ветви fijTi, 5.относятся к жидкой фазе. С увеличением температуры участок двухфазного состояния сокращается. Температура Ткр, при которой линии и БА сливаются в точку К, называется критической. Давление ркр, объем V ир и плотность Ркр, соответствующие точке К, тоже называются критическими. Когда газ при по- 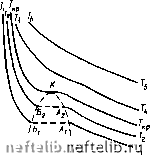 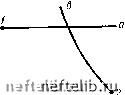 Рис. 5.1. График зависимости между р, V и Т Рис. 5.2. График изобарического /-а и изотермического 2-в процессов стоянной температуре Ткр будет сжат до объема Укр (при этом давление будет равно рр), его плотность достигнет плотности жидкости. Газ нельзя будет отличить от жидкости. Однородность вещества при этом не нарушится. Но малейшее уменьшение температуры вызовет расслоение на жидкую и паровую (газовую) фазы. При температуре выше критической газ не переходит в жидкость ни при каких давлениях. Аналитическая зависимость между р, V п Т (уравнение состояния) наиболее простой вид имеет для идеального газа, т. е. для газа, подчиняющегося законам Гей-Люссака и Бойля-Мариотта. Представим себе некоторое количество газа при состоянии / и такое же количество газа при состоянии 2 (рис. 5.2, точки 1 и 2). Газ, находящийся в состоянии /, начнем нагревать, сохраняя давление pi неизменным. Газ будет расширяться и, согласно закону Гей-Люссака, его объем при температуре Tj будет V = ViT/Ti. Газ, находящийся в состоянии 2, будем сжимать при постоянной температуре Tj. Когда давление окажется равным р, в соответствии с законом Бойля-Мариотта будем иметь V = V., pJPi- Поскольку в обоих случаях V - одна и та же величина (на рис. 5.2 она соответствует точке пересечения изобары /-а и изотермы 2-в), получим V-JJTi- Vп pJPi и далее рУТ = pVJT или pVIT = const. Постоянная величина зависит от количества газа, содержащегося в объеме У, и от его физи ческой природы. Если взять один моль газа, то, поскольку объем его V для всех газов один и тот же, одинаковой для всех газов будет и величина R. Это - универсальная газовая постоянная. Так получается уравнение состояния для одного моля идеального газа (уравнение Клапейрона) pV = RT. (5.1) Физический смысл универсальной газовой постоянной R - работа 13Я 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 [ 44 ] 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 |
||
 |
 |