
 |
|
|
Главная Переработка нефти и газа Объем грамм-молекулы полученного оксида равен: Vi/ieO=M/nD, где М - молекулярная масса оксида; п - число атомов металла в оксиде; D -плотность оксида. В том случае, когда объем пленки меньше, чем объем металла, израсходованного на ее образование, т. е. --= -< 1, образующаяся пленка не сплошная. КМе nDA Такие пленки не обладают защитными свойствами, поэтому металл подвергается дальнейшей коррозии. Если > 1, то в этом случае пленка сплошная и может nDA обладать защитными свойствами. Выполнепие условий сплошности пленки всегда является необходимым, но в ряде случаев недостаточным условием. В реальных условиях у пленок с 1мео/Уме!»1 может и не быть высоких защитных свойств, как, например, у МоОз или WO3. Поэтому ориентировочно считают, что если соблюдается условие 1,0<VMco/lMe<;2,5 - пленка сплошная, защитная; а при мео/1ме>2,5 пленка может быть незащитной, так как в процессе роста ее могут возникать напряжения, разрушающие пленку, нарушающие ее сплошность. Могут быть и другие причины разрушения образовавшейся пленки: недостаточная пластичность пленки, летучесть образовавшегося оксида, изменение кристаллической структуры пленки. Данная закономерность может быть применима и к другим видам пленок из продуктов коррозии на поверхности металла. Законы роста оксидных пленок на поверхности металлов. Процессы газовой коррозии - это многостадийные гетерогенные процессы, протекающие на границе раздела фаз металл - газовая среда. В процессе взаимодействия металла, с газообразными веществами, который сопровождается образованием пористой оксидной пленки на поверхности металла, можно выделить следующие последовательно протекающие стадии: а) транспортировка газообразных веществ к поверхности раздела фаз; б) адсорбция газа на поверхности металла; в) химическое взаимодействие; г) отвод (десорбция, возгонка) продуктов коррозии из зоны взаимодействия (в некоторых случаях). При образовании незащитной пленки (пористой) наиболее медленной (лимитирующей) стадией процесса является химическое взаимодействие (рис. 39). Скорость роста пленки для этого случая будет величиной постоянной- толщина пленки пропорциональна времени окис-dy ления: -- = k, где у - толщина пленки; т - время dt окисленпя металла, k-константа скорости химической реакции. Интегрируя данное уравнение, получим, что толщина пленки прямо пропорциональна времени: y=kx+cox\si. В большинстве случаев значение const мало или равно нулю, т. е. y = kx. Указанный линейный закон роста ок- 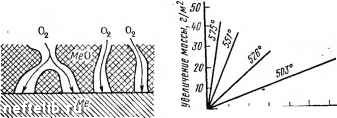 Рис. 39. Схема процесса образования пористой- оксидной пленки на повсрхностн металла О 1С гв 3D W 50 т w Времп, ч Рис. 40. Коррозия магния в атмосфере кислорода при различных температурах сидных пленок наблюдается при окислении щелочных и щелочноземельных металлов (рис. 40). При образовании на поверхности металла защитной (сплошной, непористой) пленки схему процесса (рис. 41) можно разбить на следующие отдельные стадии: а) переход металла в форме ионов и электронов из металлической фазы в оксид: Me (тв) Me б) перемещение ионов металла и электронов в слое оксида; в) транспортировка кислорода к поверхности раздела оксидная пленка - газ; г) адсорбция кислорода на поверхности оксидной пленки; д) ионизация адсорбированного кислорода; е) перемещение ионов кислорода в слое оксида; ж) химическое взаимодействие с образованием оксида. В зависимости от внешних условий, толщины и качества образующейся оксидной пленки скорость процесса определяется скоростью одной из этих стадий. При обычных температурах реакция окисления протекает по законам химической кинетики. С увеличением температуры скорость химической реакции быстро увеличивается, а диффузии возрастает очень медленно, в результате чего при высоких температурах скорость коррозии начинает подчиняться законам диффузии. Диффузионный харак-  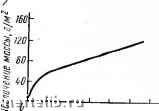 Рис. 41. Схема процесса образования защитной пленки на поверхности металла i 2 J 5 е I время, V Рис. 42. Окисление меди па воздухе при 800"С тер процесса проявляется тем резче, чем толще пленка и чем .она качественнее. Следовательно, чем выше защитные свойства пленки, тем меньше скорость ее роста. Поэтому скорость роста пленки обратно пропорциональна толщине ее, т. е. Интегрируя данное уравнение, получим параболическую зависимость у = 2kx + const или г/2 - kx + const. Из уравнения Следует, что скорость роста пленки в этом случае лимитируется только стадией диффузии и пропорциональна 1т, т. е. скорость коррозии уменьшается во времени (рис. 42). Иногда рост пленок идет с сильным затуханием, не соответствующим зависимости у = 1т. Этим процессам 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 [ 25 ] 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 |
||
 |
 |