
 |
|
|
Главная Переработка нефти и газа Глава X ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ 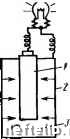 1. Механизм электрохимической коррозии Чтобы протекала электрохимическая коррозия, необходим контакт металла с раствором электролита. В водной среде механизм процесса электрохимической коррозии подобен процессу, происходящему в элементе батареи для карманного фонаря. Такой элемент (рис. 44) состоит из двух электродов: угольного - като-~ да и цинкового - анода, разделенных электролитом. Электрическая энергия образуется за счет химических реакций, протекающих на каждом электроде. На катоде - химическое восстановление, а па аноде - окисление, при эгом цинк превращается в ионы Zn+. Чтобы такие процессы протекали и гальванический элемент начал работать, необходимо замкнуть цепь. Однако растворение цинка возможно и в разомкнутой цепи, в этом случае роль катода выполняют мельчайшие примеси, находящиеся в цинке. Такие элементы называют микрокоррозионными. Они играют основную роль в процессе электрохимической коррозии. Поверхность любого металла состоит из микроэлектродов, короткозамкнутых через сам металл. Микрокоррозионные элементы начинают функционировать при контакте металла с электролитом, что приводит со временем к коррозионному разрушению металла. Таким образом, коррозионный процесс возникает и протекает-в результате работы множества короткозамкнутых гальванических микроэлементов. Причины образования микропар самые разнообразные: неоднородность металлической фазы, жидкой фазы и физических условий. Среди причин, вызывающих неоднородность металлической фазы, следует отметить неоднородность самого металла, состава защитных пленок на металле и внутренних напряжений в металле. Во время работы микрогальванического элемента одновременно протекают два электродных процесса: ilUHK корродирует Рис. 44. Принципиальная схема сухого элемента: I - угольная пластина: 2 - цинк; 3 - раствор электролита 1. Анодный - процесс перехода ионов металла в раствор с оставлением соответствующего количества электронов на поверхности металла: Ме+е- -1- «НоО::; Ме+иНгО + е- Примерами таких процессов могут служить реакции окисления: Zn:;tZn2+ --2е-AI А13+ + Зе-Fe2+ :;>: РеЗ+ + е- 2. Катодный процесс - ассимиляция избыточных электронов атомами или молекулами электролита •(деполяризаторами), которые при этом восстанавливаются. Примерами катодных процессов являются реакции восстановления: H+:5t 1/2Н2 -е- Cu2+:5±;Cu -2е- РеЗ+ Tt Fe2+ - е- метвпп pocmBofj 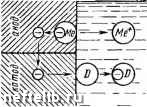 Рис. 45. Принципиальная схема электрохимического коррозионного процесса: О - катодный деполяризатор Оба указанных процесса протекают сопряженно и замедление одного из них приводит к торможению другого. Как видно из приведенных примеров реакций, разрушение (коррозия) металлов обычно происходит на аноде. Принципиальная схема электрохимического разрушения металла приведена на рис. 45. 2. Электродные потенциалы При погружении металла в раствор электролита между поверхностью металла и электролитом возникает определенная разность потенциалов, что связано с образованием двойного электрического слоя, т. е. несимметричного распределения заряженных частиц у границ раздела фаз. PaccMOTpifM явление на границе раздела фаз металл- электролит (рис. 46). В случае, если энергия гидратации ионов достаточна для разрыва связи между ион-атомами металла и электронами и ион-атомы пере- электрон g мепют зпектропип! жктрстт Рис. 46. Схема образования двойного электрического слоя: а - при переходе иона атома металла в раствор: б - при переходе катиона из раствора иа металл ХОДЯТ 6 раствор, на поверхности металла остается экви-валентное число электронов, которые сообщают поверхности металла отрицательный заряд. В дальнейщем эти отрицательные заряды притягивают катионы металла из раствора. В результате на границе раздела металл-, электролит возникает двойной электрический слой, что и вызывает появление некоторой разницы потенциалов между металлом и раствором электролита (рис. 46, о). Возможен и другой вариант формирования двойного электрического слоя на границе раздела металл - электролит. В этом случае (рис. 46, б) на поверхности металла могут разряжаться катионы из раствора электролита (энергия связи в кристаллической решетке больше энергии гидратации). В результате поверхность металла приобретает положительный заряд, который образует двойной слой с анионами раствора. Величины электродных потенциалов оказывают большое влияние на характер коррозионного процесса, т. е. необходимо знать значения этих потенциалов и действительную разность потенциалов между металлом и раствором электролита. В настоящее время нет экспериментальных способов измерения и теоретических методов расчета абсолютных значений электродных потенциалов, поэтому измеряют относительные значения потенциалов, используя для этого так называемые электроды сравнения. За основной электрод сравнения принят стандартный водородный электрод (рис. 47), представляющий собой электрод из платинированной (черненой) платины /, погруженный в раствор кислоты 2 с активностью ионов Н+ равной 1 г-ион/л. Через раствор продуваетсяво- р„с. 47. Водородный дород под давлением, пузырьки электрод сравнения 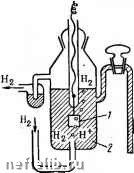 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 [ 27 ] 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 |
||
 |
 |