
 |
|
|
Главная Переработка нефти и газа параметры Aq, Bq, С, а, Ъ, с, а ж у - постоянные величины для индивидуальных веществ. Для смесей газов эти величины являются функцией состава смеси (см. табл. 2 приложений). Численные значения этих параметров для смеси углеводородов определяются по следующим формулам: где xf - молярные доли компонентов в смеси; Б о,, 4 of и т.д. - числовые значения констант соответствующих компонентов. При большом числе компонентов расчеты по приведенным формулам становятся трудоемкими. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов: pV = zmRT, (1П.38) где р - давление в Па; V - объем газа в м; z - коэффициент сжимаемости; т - масса газа в кг; R - газовая постоянная в Дж (кг-град); Т - температура в °К. Характер изменения коэффициента сжимаемости z с изменением температуры и давления можно установить, учитывая отличия реальных газов от идеальных. В последних молекулы занимают незначительный объем (по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом. Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице. С повышением давления молекулы газа сближаются и силы притяжения между ними помогают внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы. Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. В этих условиях углеводородный газ должен сжиматься меньше, чем при малых давлениях, т. е. значения z вновь возрастают с увеличением давления. Приведенное давление ррр 3 i S В 7 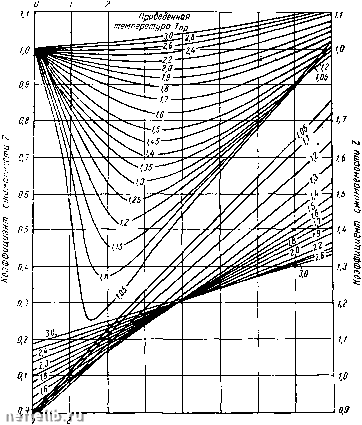 9 10 It п 13 Придеденное дабление р Рис. II 1.2. Коэффициенты сжимаемости углеводородных газов в зависимости от приведенных параметров. Коэффициент сжимаемости газов z обычно определяют по экспериментальным графикам. Чтобы избежать построения графиков для каждого газа или их смесей, на основе экспериментальных данных составлен график изменения коэффициента z в зависимости от приведенной температуры Гр и приведенного давления Рпр ДЛя метана (рис. III.2). Этот график можно использовать для определения z всех газов, состоящих на 95-96% из метана: где р тз. Т - давление и температура газа; и Гр ,• - критические давленпе и абсолютная температура г-го компонента; 22 кр i = кр Sj/zPkp I = Ркр- среднекрптические (псевдокритические) абсолютная температура п давление; г/,- - мольная концентрация г-го компонента в газе. Таким образом, р„р и Т„р выражают давление ы абсолютную температуру в долях от соответствующих критических величин. Различные газы, имеющие одинаковые приведенные температуру и давление, находятся в «соответственных состояниях». По принципу соответственных состояний термодинамические свойства веществ (в том числе и коэффициенты сжимаемости различных газов) с равными приведенными телшературой и давлением приблизительно одинаковы, так как при зтом различные газы находятся как бы в одинаковом относительном приближении к жидкому состоянию. Поэтому графики коэффициента сжимаемости z в приведенных координатах для углеводородов одного гомологического ряда совпадают с точностью, достаточной для практики. На этом основании график (рис. III.2) можно использовать для вычисления удельного объема и других параметров любого газа (в том числе и газовых смесей), если известны его критические параметры (табл. III.2). Графики (рис. III.2) действительны для газа, не содержащего значительных количеств неуглеводородных колшонентов, большую часть которых обычно составляет азот. В этом случае коэффициент сжимаемости газа можно рассчитать по правилу аддитивности из г = У8га + (1-Уа)гу, (III.40) где г/а - мольная доля азота; 2а - коэффициент сжимаемости азота (рис. III.3); 2у - коэффициент сжимаемости углеводородной части газа. На рис. III.4 приведены кривые, характеризующие степень отклонения СО а от закона идеального газа. Рассмотрим пример определения коэффициента сжимаемости газа. Пример. Найти коэффициент сжимаемости для газа, состоящего из 70% метана, 10% этана и 20% азота (по объему) при давлении 10 МПа и температуре 38° С. Смеси газов приближенно подчиняются следующему правилу аддитивности: параметры смеси пропорциональны мольным концентрациям п параметрам отдельных компонентов. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 [ 26 ] 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 |
||
 |
 |