
 |
|
|
Главная Переработка нефти и газа При изменении давления от Pi до летучесть приобретает значения и /о- После интегрирования в этих пределах получим InA= jFdp. (1П.46) Летучесть может быть вычислена по этому уравнению. Коэффициент сжимаемости z и летучесть / связаны соотношением Inj dp. (П1.47) Величину / можно определять также по приближенной формуле / = - (П1.48) Учитывая, что pV = zRT, получим fzp, (П1.49) т. е. приближенно летучесть равна произведению коэффициента сжимаемости газа на давление. Метод Льюиса распространяется также и на растворы в связи с тем, что действительная упругость паров зависит не только от температуры, но и от давления. Летучесть при этом характеризуется стремлением веш;ества в зависимости от давления и температуры перейти из одной фазы в другую. Приближенно летучесть / реальных газов (так же, как сжимаемость z) можно вычислить, воспользовавшись методом расчета, основанным на принципе соответственных состояний. Коэффициенты активности различных реальных газов оказываются равными при одинаковых значениях приведенной температуры и приведенного давления . На рис. II 1.5 приведены графики зависимости у от р„р. Каждая кривая является изотермой, которой отвечает определенная величина приведенной температуры. Важное преимущество введения функции / заключается в том, что для описания свойств и поведения реальных газов и жидких растворов можно применять простые формы уравнений, присущие идеальным системам (об этом см. в курсах физической химии). 1Герасимов Я. И., Древинг В. П., Еремин Е. Н., Киселев А. В., Лебедев В. П., Панченков Г. П., Ш л ы-I п н А. И. Курс физической химии. Т. I, М., изд-во «Химия», 1964. 3" ,7 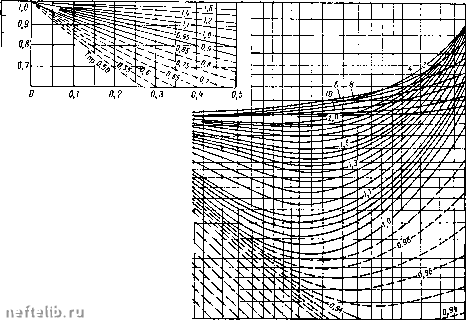 0,6 0,5 0,4 О,,?
0,г 0,3 0,4 0,6 0,8 1,0 Рис. III.5. Зависимость коэффициента активности v = = -у газов от приведенных давления рпр и температуры Гпр. 5 6 8 W За относительную плотность газа принимается число, показывающее, во сколько раз масса газа, заключенная в определенном объеме при данном давлении и температуре, больше или меньше массы сухого воздуха, заключенного в том же объеме при нормальных условиях: d-, (III.50) где Рр и Рв - плотности газа и воздуха. Чем жирнее газ, т. е. чем больше он содержит тяжелых компонентов, тем больше его плотность. Плотность газов измеряют специальными газовыми пикнометрами или же эффузивным методом, который основан на измерении скорости истечения газов из отверстий. В кинетической теории газов доказывается, что квадраты скоростей истечения газов из малых отверстий обратно пропорциональны их плотностям: 4 = - . (1П.51) i Pi где У], Уг, р, ра - соответственно скорости истечения и плотности газов. Если заменить отношение скоростей обратным отношением времени истечения равных объемов газов, получим где ti и - время истечения равных объемов газов, имеющих плотности Pi и Рг, или P2 = Pi. (111.52) Приняв за единицу плотность воздуха (рв = = 1), находят относительную плотность газа (по отношению к воздуху). Плотность газа можно также определить по его относительной молекулярной массе. Для смеси газов их средняя (кажущаяся) молекулярная масса рассчитывается по известному мольному компонентному составу газа по формуле M = yiMi + y,+ . . . +уЖ = 1>У1М1, (П1.53) где М - средняя относительная молекулярная масса газа; М, Afj, . . ., М„ - относительные молекулярные массы соответствующих компонентов; У1, у2, . . ., Уп - мольные доли компонентов. Один киломоль (кмоль) любого газа при нормальных условиях занимает объем, равный 22,4 м*. Следовательно, относительную 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 [ 28 ] 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |