
 |
|
|
Главная Переработка нефти и газа расчета количества и состава газа, выделяющегося из нефти при различных давлениях и температурах, количества и состава бензиновых фракций, содержащихся в газе, и т. д. Схемы фазовых превращений однокомпонентных систем Известно, что углеводородные газы изменяют объем подобно всем индивидуальным веществам в зависимости от температуры п давле- ния примерно в соответствии с 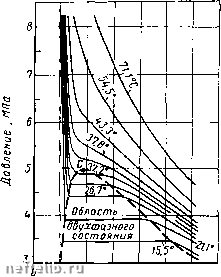 5 10 15 Удельный объем, дм/кг графиками, приведенными на рис. IV.3, а. Как видно, каждая из кривых соответствует фазовым изменениям одноком-понентного газа при постоянной температуре и имеет три сз С; о с; «о «О
10 20 30 Температура, Рис. IV.3. Диаграммы фазового состояния чистого этана. участка. Справа от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок - двухфазной газожидкостной области и левый участок - жидкой фазе. Отрезок пунктирной кривой вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума - кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической. С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конценсации, то плотность пара будет непрерывно возрастать. Для изотермических фазовых превращений однокомпонентных газов характерно постоянство давления в двухфазной области, т. е. после начала конденсации газа дальнейшее превращение его в жидкость с уменьшением объема системы происходит при постоянном давлении до тех пор, пока весь газ не превратится в конденсат. Точно также со снижением давления после начала парообразования дальнейшее кипение (испарение) жидкой фазы происходит при постоянном давлении. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара этой жидкости. Фазовые превращения углеводородов можно представить также в координатах давление р - температура Т (рис. IV.3, б). Для одно-компонентной системы кривая давления насыщенного пара на графике давление - температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах, значения которых не располагаются на этой кривой, вещество находится в однофазном состоянии - в жидком, если при данной температуре давление выше кривой давления насыщенного пара. Если при той же температуре давление ниже давления насыщенного пара, вещество находится в паровой или газовой фазе в ненасыщенном состоянии. Фазовая диаграмма индивидуальных углеводородов в координатах давление - температура ограничивается критической точкой С. Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых еще могут существовать две фазы одновременно. Величины критических давлений и температур основных компонентов природного газа приведены в табл. П1.2. Из рис. IV.3, б видно, что путем соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Действительно, газ, характеризующийся параметрами в точке А, можно путем изобарического нагрева довести до температуры в точке В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область (точка D), расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно и разделения углеводорода на фазы не произойдет. При дальнейшем охлаждении системы (от точки D до точки Е), а затем и при снижении давления до значения в точке f вещество приобретает свойства жидкости, минуя область двухфазного состояния вещества. Значительно сложнее закономерности фазовых переходов двух-и многокомпонентных систем. Схема фазовых превращений двух- и многокомпонентных систем С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают свои особенности. В качестве примера на рис. IV.4, а приведена зависимость «объем - давление» для смеси пентана и гептана с массовой концентрацией последнего 52,4%. Аналогично диаграмме на рис. IV. 3, а для однокомпонентного газа на рис. IV.4, а зона вправо от пунктирной линии (кривой точек конденсации) также является областью чистого газа, в которой изотермы двух- и многокомпонентных систем аналогичны изотермам чистых 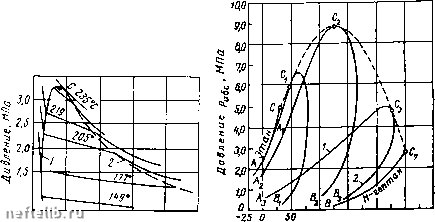 6.5 13.0 19.5 26,0 32,5 Удельный объем, дм/нй а 100 150 200 250 Температура, °С Рис. IV.4. Диаграммы фазового состояния двухкомпонентных систем. а - зависимость «давление - удельный объем» для смеси н-пентана и н-гептана, содержащей 52,4% по массе н-гептана; б - диаграмма «давление - температура» для смесей этана с н-гептаном (точки С,, Сг и Cs - критические точки смесей, содержащих соответственно 93,22, 50,25 и 9,8% по массе этана); 1 -линия точек начала парообразования; г -линия точек росы. компонентов. Влево от кривой точек парообразования изотермы жидкой фазы круто возрастают с уменьшением объема и они также аналогичны изотермам области жидкости чистых компонентов. В двухфазной же области двух- и многокомпонентных систем имеются значительные изменения. Было показано (рис. IV.3), что в области двухфазного состояния чистых углеводородов изотермы характеризуются горизонтальными линиями, т. е. давление не изменялось до полной конденсации газа. Для двух- и многокомпонентных систем, как это следует из рис. IV.4, а, давление в процессе сжатия в двухфазной области не остается постоянным и для конденсации газа необходимо повышать его для полного превращения газовой фазы в жидкость. Поэтому давление точки парообразования (кипения) для двух- и многокомпонентной смеси выше точек конденсации. В соответствии с этим не одинаков и состав жидкой и газовой фаз 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 [ 44 ] 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 |
||||||||||||||||||||||
 |
 |