
 |
|
|
Главная Переработка нефти и газа Упругость пара вещества заданного состава зависит только от температуры. В табл. 2 приведены значения упругости пара воды и нормального гексана при различных температурах [20]. Таблица 2
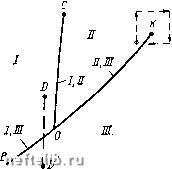 Однако переход вещества в газообразное состояние может происходить также минуя жидкое состояние. Для того чтобы проследить за фазовыми превращениями вещества, рассмотрим диаграмму, показанную на рис. 28, характерную для многих однокомпонент-ных веществ. На этой диаграмме по оси абсцисс отложена температура Т, а по оси ординат - давление р. Области диаграммы, расположенной под кривой ВОК, соответствует газообразное состояние вещества, а области, расположенной над кривой ВО - твердое состояние. Если, например, вещество вначале находилось под поршнем в твердом состоянии (точка D на рис. 28), то при сохранении постоянной температуры и уменьшении давления вещество может перейти в газообразное состояние (точка D на рис. 28). Точкам, расположенным па кривой ВО, соответствует состояние, при котором могут сосуществовать твердая и газовая фазы. Линия ОС диаграммы (см. рис. 28) разделяет области твердого состояния (область, расположенная слева от линии ВОС) и жидкого состояния (область, ограниченная линией СОК). Точкам, лежащим на линии ОС, соответствует сосуществование твердой и жидкой фаз, а точкам, расположенным на кривой ОК, - жидкой и газовой фаз. Линия ОС круто поднимается вверх. Это значит, что переход вещества из жидкого в твердое состояние происходит практи- Рис. 28. рГ-диаграмма для одноком-понентного вещества: I - твердая фаза; - жидкость; 777 - пар чески при постоянной температуре. Примечательно, что для воды линия ОС имеет отрицательный наклон, т. е. если, например, при некоторых температуре и давлении вода находилась в твердом состоянии в виде льда, то при повышении давления и постоянной температуре возможно плавление льда. Совместное существование жидкой и газовой фаз вещества возможно не при любых значениях температуры и давления. Самые высокие давление и температура, при которых могут сосуществовать жидкая и газовая фазы, наблюдаются в точке К на линии ОК. Температура и давление, соответствующие этой точке, являются критическими. В области, находящейся выше горизонтали, выходящей из точки К, и справа от вертикали, проходящей через эту же точку, вещество находится в «закритическом» состоянии. Отметим, что можно перевести вещество из жидкого состояния в газообразное и наоборот, минуя процесс кипения. Для этого нужно изменять его параметры состояния в последовательности, соответствующей, например, пунктирным линиям, показанным на рис. 28 вокруг точки К. Фазовое состояние одноком-понентного вещества может быть выражено также на диаграмме давление р - удельный объем Y (рис. 29). В качестве удельного объема можно выбрать весовой объем, т. е. например, объем 1 кг вещества, или мольный объем, т. е. объе.м 1 моля вещества. Каждой кривой состояния на этой диаграмме соответствует постоянная температура, так что эти кривые именуются изотермами. Проследим за изменением состояния вещества, двигаясь, например, по кривой 1 в направлении, указанном на рис. 29 стрелками. При высоком давлении (точка А) вещество при температуре Тх находится в однофазном состоянии (жидком). Уменьшение давления приводит к увеличению удельного объема данного вещества, причем, поскольку жидкости являются часто слабосжимаемыми, изменение давления приводит к сравнительно небольшому изменению удельного объема. В точке В будет наблюдаться выделение пара из жидкости. При дальнейшем увеличении объема количество пара будет увеличиваться и в точке С вся жидкость перейдет в газообразное состояние. Точка В называется точкой насыщения, а точка С - точкой росы. 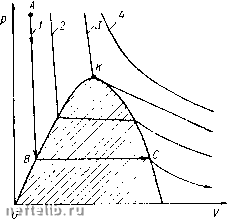 Рис. 29. рУ-диаграмма для одноком-понентного вещества: 1 ~Ти 2 - г,; л - г,; 4 - Ti При переходе однокомпонентного вещества из жидкого в газообразное состояние давление не изменяется в случае постоянной температуры. Это давление, как указывалось выше, называется упругостью пара. Двухфазное состояние вещества может существовать лишь при значениях р и V, расположенных в заштрихованной области на рис. 29. Точка К, к которой касается предельная изотерма Т, является критической. Изотермы, не пересекающие заштрихованную область, находятся в закритической области, где вещество может быть лишь в однофазном состоянии. Выше рассматривались в основном жидкое и газообразное состояния веществ. В подземных условиях углеводороды могут переходить в твердое состояние при изменении термодинамических условий. Одним из примеров образования твердого вещества в пласте является выпадение парафина из пластовой нефти. Рассмотрим теперь двухфазную смесь как физическую (термодинамическую) систему, состоящую из жидкости и газа и содержащую несколько компонентов. Эта система будет считаться находящейся в равновесном состоянии, когда количества компонентов, переходящих в каждый момент времени из жидкой фазы в газовую и наоборот, равны между собой, так что компонентные составы жидкой и газовой фаз остаются неизменными. Равновесные системы существуют при постоянном значении давления и температуры. Типичная рГ-диаграмма для системы, состоящей из двух веществ-компонентов, показана на рис. 30. В этой системе каждый компонент содержится, конечно, в строго определенной весовой пропорции. Вместо одной линии, разделяющей жидкую и газовую фазы в случае однокомпонентного вещества, на рГ-диаграмме для двух-компонентной системы существует область двухфазного состояния. Переход из жидкой фазы в газовую и наоборот происходит не при одном и том же значении давления или температуры, как в случае однокомпонентного вещества, а при изменении этих параметров. Точка К на диаграмме рис. 30 является критической. Пунктирные кривые внутри области двухфазного состояния соответствуют различному содержанию жидкой фазы в системе, выражаемому в долях единицы по объему или весу. Интересно, что двухкомпонент-ная система может существовать в двухфазном состоянии при давле- 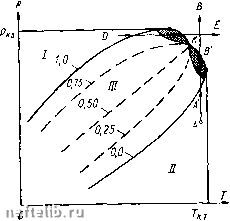 Рис. 30. рГ-диаграмма для двухком-понентного вещества: / - жидкость; II - газ; ГГГ - двухфазная область 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 [ 17 ] 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|||||||||||||||||||||||||
 |
 |