
 |
|
|
Главная Переработка нефти и газа ниях и температурах, превышающих критические. Наибольшее давление р (см. рис. 30), при котором эта система может находиться в двухфазном состоянии, называется криконденбар, а наибольшая температура, возможная при двухфазном состоянии, называется крикондентерм (Г)- yoF-диаграмма для двухкомпонентной системы показана на рис. 31. В отличие от аналогичной диаграммы для однокомпонент-ного вещества изотермы, находящиеся в двухфазной области, имеют наклон, вызванный уже упомянутым выше явлением - изменением давления при переходе от жидкого к газообразному состоянию. Это явление физически вполне понятно. В самом деле, из двух компонентов, составляющих систему, один более летучий, чем другой. Поэтому при достижении точки росы появляется жидкая фаза, в которой преобладает менее летучий компонент. Для того чтобы превратить в жидкость часть вещества системы, оставшуюся в газовой фазе, которая теперь содержит больше летучего компонента, чем прежде, нужно увеличить давление. Поэтому изотермы двухкомпонентного вещества в двухфазной области имеют наклон. Двухкомпонентная система в отличие от одноком-понентного вещества обладает еще одной особенностью. Если рассматривать рГ-диа-грамму (см. рис. 30), то обращает на себя внимание следующий факт. Предположим, что изменяют состояние двухкомпонентной системы, двигаясь снизу вверх по линии АВ. До пересечения с нижней граничной кривой двухфазного состояния (при подходе к точке А) система находится в газообразном состоянии. На участке АВ вертикаль АВ будет сначала пересекаться с пунктирными линиями, соответствующими малому содержанию жидкой фазы (цифрами на рис. 30 обозначено содержание жидкой фазы в двухфазной системе). Затем содержание жидкости в двухфазной системе будет увеличиваться и, наконец, достигнув максимума, станет уменьшаться, а миновав точку система снова перейдет в газообразное состояние. В случае однокомпонентного вещества, находящегося при определенном постоянном значении температуры, повышение давления должно вызывать лишь его переход в жидкое состояние. В двухком- 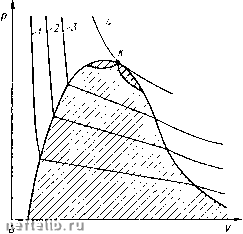 Рпс. 31. р F-дпаграмма для двухкомпонентного вещества: 1 - т,; s ~ Тг; 3 ~ тз; 4 - т,\ К - критическая точка понентной же системе при изменении ее рУГ-состояния в заштрихованной области на /)Г-диаграмме, как это показано выше, наблюдаются и обратные явления. Так, при изотермическом снижении давления (при движении вниз по линии АВ) наблюдается увеличение жидкой фазы. То же самое будет наблюдаться при изобарическом (р = const) повышении температуры. При движении по линии, например, DE количество жидкой фазы в системе может на некотором участке заштрихованной области не уменьшаться, как это следует из аналогии с однокомпонентным веществом, а увеличиваться. Описанные выше явления называются ретроградными, т. е. соответственно изотермической и изобарической ретроградной конденсацией или испарением. Эти явления наблюдаются при изменениях состояния систем, соответствующих заштрихованным областям рГ-диаграммы. На pF-диа-грамме эти области также показаны штриховкой. Ретроградные явления свойственны не только двухкомпонент-ным, но и многокомпонентным системам. Приведенные выше pV- и • рГ-диаграммы описывают состоя-для двух- ние двухкомпонентных систем, имеющих лишь определенное содержание одного и другого однокомпонентного вещества в системе в целом. Поэтому при каждом изменении состава системы в целом требуется применение новой диаграммы. Иным способом изображения состояния двухкомпонентных систем различного состава является использование диаграмм давление р - состав С (т. е. рС-диаграмм). Одна из таких диаграмм показана на рис. 32. Диаграммы с использованием в качестве переменной состава С системы применяются и для описания состояния трехкомпонентных систем. Необходимость использования рС-диаграмм вызывается еще и сле-ДУЮ1ЦЙМ обстоятельством. Как на рТ-, так и на рУ-диаграммах нельзя изображать составы газовой и жидкой фаз двухкомпонентной системы, что бывает необходимо при ряде расчетов. Использование же /?С-диаграл1мы позволяет это сделать. Нижняя кривая на joC-диаграмме является кривой точек росы, а верхняя - кривой насыщения. На рС-диаграмме можно не только отражать фазовое состояние двухкомпонентной системы, что позволяет узнать, находится ли она в одно- или двухфазном состоянии, по и определять, сколько весовых или молярных долей вещества приходится на жидкую 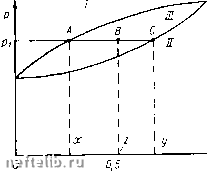 Рис. 32. рС-диаграмма компонентного вещества: I - жидкость; /; - газ; f/f - область двухфазного состояния и газовую фазы и каков состав фаз в количественном отношении. Однако каждую рС-диаграмму можно использовать для определенного значения температуры Т. Рассмотрим более подробно особенности />С-диаграммы. Пусть на />С-диаграмме (см. рис. 32), построенной для определенного значения температуры Т = const, задан точкой В состав двухкомпонентной смеси. Для определения состава двухкомпонентной смеси, очевидно, достаточно задать весовое или молярное содержание одного из компонентов в смеси (например, как это сделано на диаграмме рис. 32, молярную долю z более летучего компонента, соответствующую точке В). Если состав некоторой двухфазной системы находится на />С-диаграмме на прямой АС ъ очень близкой окрестности точки С, то эта система состоит в основном из газовой фазы и имеет лишь каплю жидкости. Для систем, содержащих достаточно большое число молекул как в жидкой, так и в газовой фазах, можно считать, что состав жидкой и газовой фаз практически не изменяется при изменении общего количества вещества в каждой из фаз. Если постепенно удалять из системы газовую фазу и сохранять неизменными давление и температуру, то содержание в системе более летучего компонента будет уменьшаться практически пропорционально уменьшению количества газовой фазы. Выведем теперь формулу, определяющую содержание фаз в двухкомпонентной системе. Итак, пусть в двухкомпонентной системе содержится п молей вещества, из которых в жидкости находится Til молей, а в газе Wg молей вещества. Если говорится, что в системе находится п молей вещества, то под этим понимается общее число молей различных компонентов. Например, 3 моля вещества могут быть составлены из 2 молей метана и одного моля пропана, 1,5 моля пропана и 1,5 моля зтана и т. д. Имеем, очевидно, п = rit -{-rig. Рассматривая баланс более летучего компонента в системе, получаем П[Х Tigi/ - nz (см. рис. 32). Из этого и предыдущего соотношений получаем Таким образом, если на />С-диаграмме заданы давление pi и общий состав двухкомпонентной смеси (точка z), то, проведя горизонталь через точку Pi и восстановив перпендикуляр из точки z, легко находим точки А, В и С vi определяем составы жидкой и газовой фаз (соответственно точки х vi у яа оси абсцисс). Количества жидкой и газовой фаз определяются по формуле (3.14). Рассмотрим теперь трехкомпонентную систему. Возьмем для этой системы />С-диаграмму, справедливую, естественно, при определенном значении температуры Т = const. Для описания фазового состояния трехкомнонентных систем используют треугольные диаграммы. Одна из таких диаграмм показана на рис. 33 для системы, состоящей из компонентов Ai, А и Ag. При этом точке А диаграммы соответствует доля компонента 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 [ 18 ] 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
||
 |
 |