
 |
|
|
Главная Переработка нефти и газа хотя условно и принято считать ее газовой, если объем фазы превосходит критический, и жидкой, если объем ее меньше критического. Следует заметить, что в критической точке свойства газовой и жидкой фаз становятся одинаковыми, и поверхность раздела между ними исчезает. Действительно, увеличивая при постоянном объеме температуру жидкой фазы сверх критической, а затем, дав объему расшириться и сбросив температуру до первоначального значения, как это показано стрелками ABCD на фиг. 1, можно завершить процесс в газовой фазе, не получая заметного разрыва при фазовом изменении. Взаимная связь различных изотерм может быть заменена нанесением на график исходных данных в виде изобар, т. е. кривых постоянного давления. Такая диаграмхма для этана приведена на фиг. 2. Физический смысл этих кривых будет очевиден, если представить себе вещество заключенным в сосуд, закрытый движущимся поршнем, подверженным постоянному давлению. Тогда кривые на фиг. 2 покажут, что случится с объемом системы для этана, т. е. для положения поршня, по мере изменения температуры в сосуде. Так, для давлений сверх критического, например 55,5 ат, объем системы непрерывно возрастает с одновременным ростом температуры. Хотя небольшой наклон кривых при низких температурах наводит на мысль о связи с жидкой фазой, а быстрое увеличение объема с ростом температуры соответствует наличию газовой фазы, все же этан является однофазной жидкостью на всем температурном интервале. При давлениях ниже критического наклоны кривых не являются уже сплошь непрерывными. Так, например, при давлении 44,2 ат объем этана медленно возрастает с увеличением температуры, когда последняя относительно мала. Это типично для поведения жидкой фазы, и, действительно, этан в этой области является жидкостью. При температуре 27,8° С объем этана можно увеличить более чем 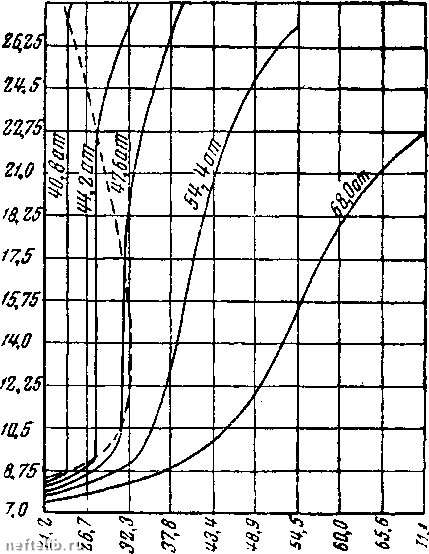 Температура "С Фиг. 2. Изобары для этана. в два раза оез всякого изменения температуры или давления. Объяснение этому явлению, разумеется, следует искать в испарении жидкой фазы. После того как испарение закончится, рост температуры системы можно возобновить, и он будет сопровождаться быстрым увеличением объема, характерным для газовой фазы, в которую испарилась жидкость. Как и на фиг. 1, кривые фиг. 2, проходящие через точки разрыва непрерывности, будут представлять собой кривые точек конденсации и парообразования и относиться соответственно к насыщенному пару и насыщенной жидкости. В табл. 1 приведены значения критических постоянных для парафиновых углеводородов. Эти константы, быть может, представляют собой наиболее характерные параметры, определяющие термодинамические свойства однокомпонентных систем. Таблица 1 Критические постоянные для парафиновых углеводородов
Метан СН4 Этан CgHg . . . Пропан CgHg . . я-Бутан С4Н10 . Изобутан С4Н10 и-Пентан СдНо , Изопентан С5Н12 я-Гексан CgHi4 . я-Гептан C7Hig , я-Октан CgHis . 16,01 30,07 44,09 58,12 58,12 72,15 72,15 86,17 100,20 114,22 •-S2.4 32,2 96,8 153,1 134 197,2 187,7 234,7 567 259,8 46,75 49,2 42,8 36,7 37,6 33,6 33,5 30,1 27,5 25,7 6,16 4,93 4,42 4,44 4,27 4,31 4,27 4,27 4,14 4,31 Табл. 1 показывает, что с увеличением молекулярного веса углеводорода критическая температура возрастает, а критический объем падает (за исключением CgHis), критическое жс давление максимально для СгНе. Для высокомолекулярных членов парафинового ряда это значение гораздо меньше и для октана падает почти до половинного значения. 2.2. Коэффициенты сжимаемости чистых углеводородных газов. Режим PVT даже одножомпонентной системы, т. е. для индивидуальных чистых углеводородов, следует рассматривать с количественной стороны как экспериментальную задачу. До сих пор еще не получено уравнений, которые воспроизвели бы количественно полученные опытным путем данные на полном интервале физических переменных. Даже в отдельности для газовой или жидкой фазы аналитические уравнения, относящиеся к различным углеводородам, не имеют простой физической взаимосвязи. Несмотря на это, полезно сравнить фактическое поведение углеводородов при фазовых изменениях с так называемыми J В некоторых случаях Z носит еще наименование «коэффициента сверхсжимаемости». «идеальными» системами. Для идеальных газов уравнение состояния может быть написано в виде pv=, (1) где V - объем на единицу веса, т. е. удельный объем; р - абсолютное давление; Т - абсолютная температура; М - молекулярный вес; R - газовая константа на моль. Уравнение (1) выражает известные законы газового состояния, которые были открыты опытным (путем при изучении фактического псведения газов ъ интер!вале умеренных давлений и температур. Из кинетической теории тазов известио, что уравне-ние (1) описывает поведение газа, состоящего из отдельных молекул, не имеющих между собой взаимодействия, кроме случаев столкновения. Отсюда реальный газ более всего приближается к идеальной системе при низких давлениях и больших молярных объемах. Это можно подтвердить заранее тем фактом, что гиперболичеокое изменение изотерм, требуемое уравнением (1), фактически выполняется ближе всего при низких давлениях. Отклонение истинного поведения системы от сформулированного уравнением (1) удобнее всего получить, нанося на график величину, обычно именуемую «коэффициентом сжимаемости» или «коэффициентом отклонения» для газа, а именно: Z = . (2) как функцию от р и Г. Если урамение (1) строго выдерживается, то Z должно равняться единице для всех значений р и Т, На фиг. 3 приведен типовой график значений Z для р - изотерм этана. Видно, что значение Z уменьшается от единицы при низких давлениях до минимума, а затем почти линейно возрастает при более высоких давлениях. Приближение кривых к значению ординаты - единица, при исчезающе малых давлениях - означает, что осетояние газа близко к идеальному. Отклонение от идеального поведения (Z=l) с повышением давления быстрее происходит с понижением температуры. Для температур ниже критической графические зависимости круто обрываются по кривой точке конденсации и опускаются вертикально через область конденсации жидкости, пока не будет встречена кривая точек парообразования. Разумеется, в этой области свойства всей системы так далеки от поведения идеального газа, что принимать идеальную систему за эталон будет весьма искусственно. Однако ввиду того, что поведение системы, характеризующееся разрЫ1Во>м 0 1 2 3 4 5 [ 6 ] 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 |
|||||||||||||||||
 |
 |