
 |
|
|
Главная Переработка нефти и газа имеет пять эмпирических постояиных Фактически только очень недавно была разработана удовлетворительная кинетическая теорР1я механизма, объясняющая процесс конденсации жидкости. Из кривых р - V - Т легче всего получить коэффициенты теплового раснгирения или изотермичеокого сжатия. Интересно отметить, что кривые Z указывают направление отклонения этих коэффициентов от соответствующих значений для идеального газа. Из определения Z согласно уравнению 2.2(2) имеем для коэффициента теплового расширения Значение по-следрюго у идеального газа 1/Т, но Z> 0. Отсюда знак при определяет, является ли коэффициент теплового расширения больше или меньше соответствующего коэффициента для идеального газа. Ооновьгваясь на этом критерии, получаем (фрг. 3), что в подлинно газовой фазе и ниже критической температуры коэффициенты теплового расширения реальных газов, превышают соответствующие значения идеального таза. Это справедливо также и при температурах значительно выше критической, а также для умеренных давлений. В подлинно жидкой фазе при температурах ниже критической изо- 7 dZ термы Z в конце концов пересекаются, а при увеличении давления за пределы критического становится отрицательной величиной. Тогда коэффициенты теплового расширения падают до очень низких значений, обычно связанных с нормальными жидкостями. Аналогичное поведение получается при высоких давлениях и температурах выше критической. Коэффициент изотермической сжимаемости, исходя из уравнения (3), имеет следующий вид: L - L L (А\ V dp р Z dp Из фиг. 3 видно, что коэффициенты сжимаемости реальных газов превышают соответствующие коэффициенты идеального газа, так как -г-<С О в подлинно газовой фазе. Это свойство (7/7 сохраняется и для температур, превышающих критическую, вплоть до точки Бойля - давления, при котором Z минимально. Для давления выше точки Бойля - положительно, и сжимаемость падает ниже соответствующей величины у идеального газа. В подлинно жидкой фазе и особенно для температур зна- чительно выше критической член (1/Z) возрастает до значения 1/р с очень малым остатком. Как и следует ожидать, ко- 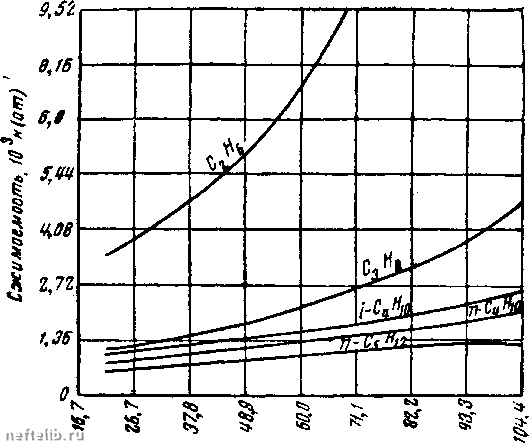 Температура, С Фиг. 4. Изменение сжимаемости к для чистых углеводородов при давлении 170 am в зависимости от температуры. нечная сжимаемость имеет тот же порядок величин, что у коэффициентов, связанных обычно с нормальными жидкостями. На фиг. 4 нанесены кривые сжимаемости углеводородов от этана до «-пентана при давлении 170 ат. На фиг. 5 на несены кривые зависимости упругости пара парафиновых углеводородов, т. е. давления точки конденсации или парообразования, от температуры. Граничная кривая (штрих) дает критические точки для этих углеводородов. Аналитически представленные данные могут быть описаны приближенно уравнением Клапейрона, а именно: - ь/т 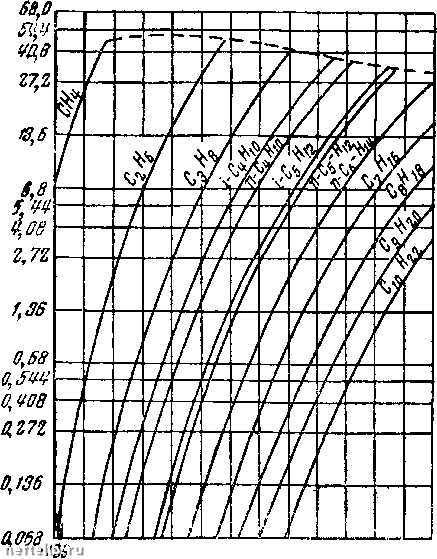 -73,4 37,8 333 Темпераmi/pa. °0 Фиг. 5. Кривые упругости пара для парафиновых углеводородов. • (5) Они часто изображаются в специальна подобранных масштабах (диаграмма Кокса) так, чтобы полу- чить сходящиеся прямые линии для всех углеводородов. 2.4. Двухкомпонентные системы. Практически двухкомпо-нентные или бинарные углеводородные системы представляют тот же итерес, что и однокомпонентные. Нефть и связанные с нею газы являются смесью многих индивидуальных углеводородов. Более подробное рассмотрение свойств бинарных систем весьма поучительно, так как в этих простых смесях можно встретить практически все новые свойства сложных углеводородных жидкостей. Прежде чем приступить к количественному рассмотрению физических или термодинамических свойств бинарной системы, необходимо уточнить состав смеси. Это относится не только к определению каждого из двух углеводородных компонентов, но и к относительному количеству каждого в сложной системе. Последнее можно выразить либо в весовых, либо в мольных концентрациях. Мольную концентрацию каждого компонента можно представить как отношение числа молей данного компонента к общему числу 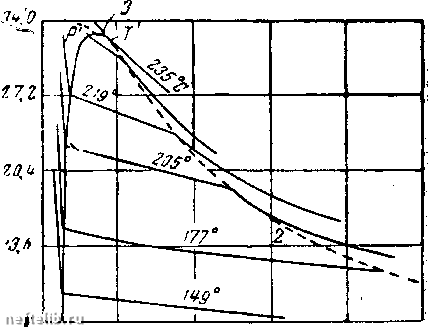 6,5 fS,0 t9,5 Удельный, оъем дгл/нг 25,0 31,5 молей всей системы I Фиг. 6. Зависимость „объем-давление* для смеси «-пентана и я-гептана, содержащей 52,4% по весу н-гептана. 1 - кривая точки парообразования; 2 - кривая точки конденсации; 3 - критическая точка. Одной из важных характеристик бинарных систем является изменение их термодинамических свойств в зависимости от состава. Однако при изучении влияния основных переменных - давления и температуры - состав рассматриваемой бинарной системы должен быть уточнен и сохранен неизменным. Поведение действительных бинарных смесей показано на фиг. 6, где нанесены изотермы для смеси н-пентана и н-гептана, содержащей 52,4% по весу «-гептана. В газовой фазе, т. е. вправо от кривой точки конденсации, изотермы довольно пологи и аналогичны изотермам чистых ком- Можно ле1К0 перейти от весовой концентрации, ct; к мольной концентрации щ многокомпонентных систем при помощи выражения = = (mJM)l{i:oj/M), где - молекулярный вес i-io компонента. Обратно: 0 1 2 3 4 5 6 7 [ 8 ] 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 |
||
 |
 |