
 |
|
|
Главная Переработка нефти и газа Значения приведенных параметров отвечают отношениям наблюдаемых значений к критическим в абсолютных единицах Pr = Т = r Гк (1.7) ПсеВдоприведенное давление 2 3 i< 5 6 ПсеВдоприбеде нная температура 3xL " 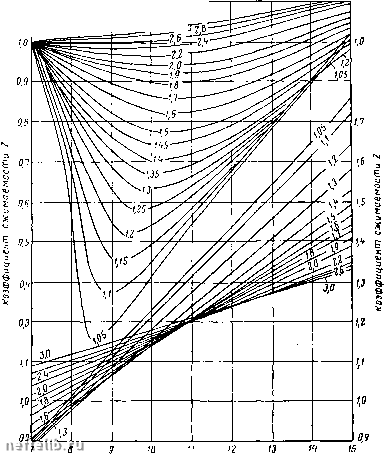 Приведенное давление Рис. 1. Коэффициент для углеводородных газов в функции приведенных давлений и температур Гд. В табл. 1 приведены значения критических температур и давлений для некоторых в основном углеводородных газов [5]. Уравнение состояния жидких и твердых тел дается обычно в виде экспериментальных графиков функций (I. 3) - упругости, Таблица Т. Физические свойства компонентов попутных нефтяных газов
температурного расширения и пр. Вообще вместо уравнения состояния тина (1. 1) может быть задана любая термодинамическая функция, о чем более подробно будет сказано дальше. По существу температура, выраженная в явном виде из уравнения состояния {I. 1) как функция внешних параметров р ж V, является также термодинамической функцией, а именно Т = ц>{р,У), (1.8) полный дифференциал которой равен Из сопоставления (1.3) и (1.9) вытекает физический смысл частных производных, а именно: -)=--; (l7)p=4* " КИМ образом, выражение (1.9) можно записать так dp . dlnV dT = (1.10) б a • Уравнение (I. 10) и опытные кривые б {р, F) и а (р, V) могут заменить уравнение состояния. I 3. НАЧАЛА ТЕРМОДИНАМИКИ Полная энергия единицы массы системы может быть представлена в виде суммы трех членов Е=.Е-\Е,+ , (Г. И) где E.U1 и Ez - кинетическая и потенциальная энергии единицы массы во внешнем потенциальном ноле в кГ • м/кг; U - внутренняя энергия в ккал/кг как термодинамическая функция внешних параметров р, V ж температуры Т; А = 2,344 • 10~* ккал/кГ • м - тепловой эквивалент работы. Первое начало термодинамики является частным случаем общего закона сохранения энергии и может быть выражено так dQ = AdE + AdL. (1.12) Здесь Q - тепло, подведенное к системе в ккал/кг; L - внешняя механическая работа, произведенная системой, в кГ • м/кг. Если система находится в покое и внешние силы на нее не действуют, т. е. Еу, = Ez = О, то приращение внутренней энергии определяется так dU = dQ - ApdV. (1.13) Математическое выражение второго начала термодинамики для общего случая имеет вид dQ = T ds, (1.14) где s - термодинамическая функция, называемая энтропией системы, в ккал/кг • °К. Энтропия является однозначной функцией состояния системы и определяется двумя независимыми параметрами (Fnp, р и Т или Г и F). Энтропия сложной системы равна сумме энтропии ее частей. Знак равенства в формуле (I. 14) относится к обратимым термодинамическим процессам, протекающим в квазистатических условиях. Считается доказанным, что энтропия изолированной системы тел ни при каких обстоятельствах не может быть зшеньшена. Для быстропротекающих необратимых термодинамических процессов энтропия системы возрастает без какой-либо передачи тепла или §-<ds, (1.15) Согласно третьему началу термодинамики, все термодинамические функции в области нулевой абсолютной температуры, т. е. Г -> О перестают зависеть от температуры; это значит, их частные производные по температуре обращаются в нуль. Ограничиваясь рассмотрением трех термодинамических функций - температуры Т, внутренней энергии U и энтропии s, можно было бы построить всю термодинамику. Однако многие положения термодинамики объясняются проще и более наглядно, если ввести и другие термодинамические функции. § 4. ТЕРМОДИНАМИЧЕСКИЕ Одной из характеристических тер-ШУНКЦИИ модинамических функций являет- ся, как уже было сказано, энтропия системы S. Из (I. 14) следует, что процессы, происходящие при постоянной энтропии, или так называемые адиабатические процессы 0 [ 1 ] 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |