
 |
|
|
Главная Переработка нефти и газа Для однозначной ее характеристики необходимо знать три ребра {а, й и с) и три угла между осями а, § и у (см. рис. 4). 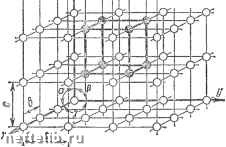 Рис. 4. Схема кристаллической решетки Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемноцентрированную, ку-
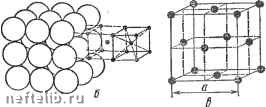 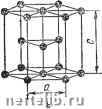 Рис. 5. Кристаллические решетки металлов! с и б - кубическая объемиоцентрированная (о. ц. к.); е - кубическая гранецентрироваи-иая (г. ц. к.); г - гексагональная плотноупа-кованная бическую гранецентрированную и гексагональную (рис. 5). Как видно из рис. 5, а, вкубической объ-емноцентрированной решетке (о. ц. к.) атомы расположены в углах куба и один атом в цгптре объема куба. Кубическую объемноцентрированную решетку имеют металлы Rb, К, Na, Li, Tip, Zrg, Та, Fca. Mo. V/, V, Cr, Ba и др. Б кубической гранецентрирован-ной решетке (г. ц. к.) атомы расположены в углах куба и в центре каждой грани (рис. 5, б). Эту решетку имеют металлы Са, Се, Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, Ir, Fe.,, Cu и др. Бгексагональной решетке (рис. 5, е) атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Эту упаковку атомов имеют металлы Mg, Ti, Cd, Re, Os, Ru, Zn, Co„, Бе, Tl„, Zr„ и др. Расстояния между центрами ближайших атомов в элементарной ячейке (см. рис. 5) называются п е -риодами решетки. Период решетки выражается в нанометрах нм (1 нм = 10~* см). Период решетки а для большинства металлов находится в пределах от 0,1 до 0,7 нм. На одну элементарную ячейку объемноцентрирован-ной решетки в целом (т. е. в совокупности с другими соседними ячейками) приходятся два атома: один атом в центре куба и один атом вносят атомы, располагающиеся в вершинах куба. Поскольку каждый атом в вершине куба одновременно принадлежит "восьми элементарным ячейкам (см. рис. 5, а), то, следовательно, на данную ячейку приходится лишь % массы этого атома, а на всю решетку Vs-S = 1- На одну элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один атом (по такому же расчету, как и для объемно-центрированной решетки) вносят атомы, находящиеся в вершинах куба (Vs-S). а три атома вносят атомы, находящиеся на середине грани, так как каждый из них принадлежит двум решеткам. Следовательно: VsX Хб -h Vs-S = 4 атома. На элементарную ячейку гексагональной плотно-упакованной решетки приходятся шесть атомов (3 + -f Ve-12-bV2-2 = 6). Плотность кристаллической решетки, т. е. объем, занятый атомами, которые условно можно рассматривать как в достаточной степени жесткие шары (см. рис. 5, е), характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от одного (так называемого базисного) атома. Чем выше координационное число, тем больше плотность упаковки атомов. 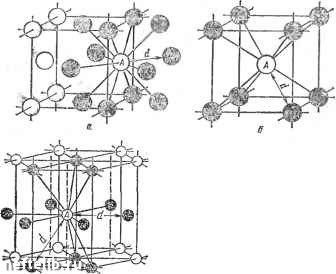 Рис. 6. Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от данного атома для различных решеток: а - кубическая гранецентрн-рованная; б - кубическая объемиоцентрированная; в - гексагональная плотиоупакован-пая Если взять за базисный атом А, находящийся в центре куба, легко видеть (рис. 6, а), что на ближайшем расстоянии от него находятся 8 угловых атомов. Следовательно, координационное число для этой решетки 8 (К8) и коэффициент заполнения, определяемый как отношение объема, занятого атомами, к объему ячейки, составляет 68 %. Для гранецентрированной (г. ц. к.) кубической кристаллической ячейки координационное число 12 (К12); калодый атом имеет 12 ближайших соседей (рис. 6, б). Гексагональная плотноупакованная решетка, имеющая отношение с/а - 1,633, имеет координационное число 12 (Г12), что также соответствует наибольшей плотности упаковки атомов (рис. 6, в). В большинстве металлов, кристаллизующихся в гексагональной си- 0 1 [ 2 ] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 |
||||||||
 |
 |