
 |
|
|
Главная Переработка нефти и газа Содержание влаги, мг м"* (15°С,кПа(абс.) 200- 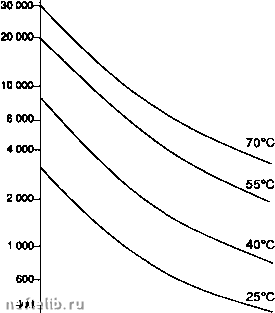 700100" Давление, кПа (абс.) -I-1- 3 000 5 000 СО, 10 000 20 000* Содержание влаги, мг м- (15°С,кПа(абс.) 1 ООО 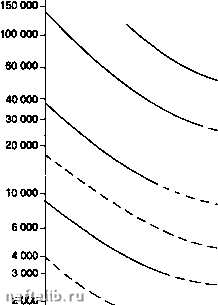 las-c lOS-C 7001 -I-г 3 000 5( 55°С . 25С Давление, кПа (абоУ 10000 20000 Корректировка точки росы где: у - молярная доля паров воды, к - эмпирическая функция летучести паров воды и давления, 1щ - летучесть паров воды при определенной температуре и давлении, f- летучесть газа при определенной температуре и давлении, Z - уточненный коэффициент сжимаемости. Совсем недавно была опубликована методика расчета влагосодержания кислых природных газов, базирующаяся на модификации уравнения состояния Редлиха-Квонга; она разработана Робинсоном и коллегами и может легко стать составной частью программы расчетов [5]. 2.4.6.1.2. Гидраты Гидрат - это твердое тело, образованное физическим соединением молекул воды и определенным числом молекул газа. Молекулы после л-бутана слишком велики, чтобы проникнуть в полости кристаллической решетки, таким образом углеводороды выше л-бутана не образуют гидраты. Единственное решение для предупреждения гидратообразования - это создание комплекса условий по температуре и давлению, возможно дальше отстоящих от условий их образования гидра-тов(т.е. снижение давления и увеличение температуры); разложение, по соображениям эффективности и безопасности, обычно осуществляется с двух сторон гидратной пробки. Условия, необходимые для образования гидратов: - присутствие свободной воды и газа ниже их точки росы, - выполнение условий по температуре и давлению в зависимости от состава газа. Ниже указаны различные методы определения по Р-Т области образования гидратов. 2.4.6.1.2.1. Метод Катца Дается равновесная кривая в зависимости от относительной плотности газа по воздуху (см. с. 332) (приближенный метод) [6]. 2.4.6.1.2.2. Метод Катца и Карсона Этот метод вводит константы равновесия твердое тело - пар для каждой компоненты в зависимости от давления и температуры. Расчеты точки образования гидратов проводятся таким же образом, как и точки росы. Давление образования гидратов (кЛа абс) 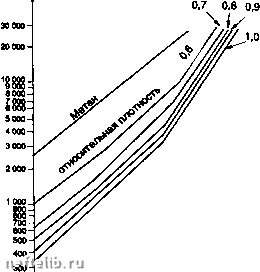 200- -г 20 Температура (°С) Давление (бар абс) Кривая гидратов 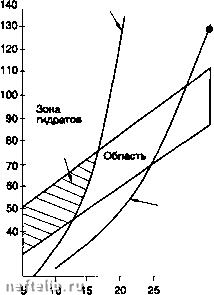 ННачальные условия Кривая росы Температура (°С) -I-1-г* 30 35 40 ОСазоаание гидратов (метод Катцв) Диаграмма образования гидратов. 2.4.6.1.2.3. Метод Трекела и Кемпбела [4] Этот метод использует серию кривых, которые позволяют осуществить графическое определение. Представляется однако, что его применение приводит к значительным ошибкам для газов с повышенным содержанием кислых газов. Эта корреляция имеет чисто эмпирическую природу и действительна строго только для тех областей, для которых они были получены. Более точные результаты в настоящее время получены в работах Пенга и Робинсона. Их метод базируется на термодинамических соотношениях. Он представлен в виде профаммы [6]. 2.4.6.1.3. Осушка природного газа Доводы следующие: - предупредить образование гидратов после обработки, - удовлетворить требованию точки росы по воде, - предупредить коррозию в присутствии кислых газов. - Для предотвращения гидратообразования, когда параметры установки находятся в термобарических условиях гидратообразования, существует три способа решения проблемы (см. следующий рисунок); - перемещение кривой образования гидратов: ввод ингибитора, который снижает температуру образования гидратов; - перемещение кривой точек росы: абсорбция паров воды с помощыо жидкого сорбента или адсорбция паров твердым осушителем; - перемещение области функционирования: дегидратация путем охлахздения и расширения. 2.4.6.2. Ингибирование гидратов Ингибиторами являются: - спирты: метанол, этанол, изопропанол, - гликоли: моноэтиленгликоль, диэтиленгликоль, триэтиленгликоль, - аммиак. 2.4.6.2.1. Расход ингибитора Количество ингибитора, которое необходимо ввести, можно определить с помощью экспериментального уравнения Гаммершмидта lOOdM K-HdM где: W - массовая доля ингибитора, % в смеси вода + ингибитор, d - понижение температуры гидратообразования (°F). М - молекулярная масса ингибитора, К - коэффициент, зависящий от природы ингибитора. Следующая таблица дает значения молекулярных масс и коэффициентов К для нескольких ингибиторов.
Эффективность ингибитора тем выше, чем М меныие отношение ~. Количества ингибитора, определенные по уравнению Гаммершмидта, должны быть увеличены, чтобы учесть частичное испарение и/или растворение в имр/лой углеводородной фазе. Наиболее часто используемые ингибиторы -это метанол и гликоли (моноэтиленгликоль, диэтилен-гликоль). 2.4.6.2.2. Различные типы используемых ингибиторов 2.4.6.2.2.1. Метанол Он используется обычно без регенерации (потерянный метанол), но также может быть получен обратно с жидкой фазой и регенерирован с помощью перегонки (см. таблицу ниже). Область применения: - Небольшие установки охлаждения путем расширения. - Периодическое (сезонное) впрыскивание в трубопроводы, охлажденные окружающей средой. - Небольшое количество газа, подлежащего обработке. - Точечные впрыскивания на установках для борьбы с гидратами, которые могут образоваться по некоторым обстоятельствам (падение давления, охлаждение и т.д.).
Свойства гликолвй и метанола. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 [ 102 ] 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |