
 |
|
|
Главная Переработка нефти и газа Атомный номер Название Обозначение Относительная атомная масса (1)
89 13 95 51 47 18 33 85 7 56 97 4 83 5 35 48 20 98 8 56 55 17 24 27 29 96 66 99 68 50 83 26 100 9 87 64 31 32 72 2 87 49 53 77 38 57 103 3 71 12 Актиний люминий Америций Сурьма Серебро Аргон Мышьяк Астат Азот Барий Берклий Бериллий Висмут Бром Кадмий Кальций Калифорний Углерод Церий Цезий Хлор Хром Кобальт Медь Кюрий Диспрозий Эйнштейний Эрбий Олово Европий Железо Фермий Фтор Франций Гадолиний Галлий Германий Гафний Гелий Гольмий Водород Индий Иридий Криптон Лантан Лоуренсий Литий Лютеций Магний 227,0278 26,98154 (243) 121.75 ±3 107.868 2 ±3 39,948 74,9216 (210) 14,0067 137.33 (247) 9,01218 208,9804 10,81 79,904 112,41 40,08 (251) 12,01115 140,12 132,9054 35,453 51,996 58,9332 83.546 ±3 (247) 162,50 ±3 (252) 167,26 ±3 118,69 ±3 151,96 55,847 ±3 (257) 18,998403 (223) 157,25 ±3 69,72 72,59 ±3 178,49 ±3 4,00260 164,9304 1,00794 ±3 114,82 126,9045 192,22 ±3 83,80 138.9055 ±3 6,941 ±3 174,967 24,305 (1) В системе, в которой атомная масса углерода 12 равна 12, Таблица относительных атомных масс. Координационная связь (или донорно-акцептор-ная): в этом случав один из присутствующих атомов предоставляет пару электронов. Элемент, являющийся донором*, имеет по меньшей мере один свободный дублет (фосфор, кислород, сера и галогены), который становится общим для другого атома *акцептора", имеющего свободные орбиты (бор, алюминий). Пример: SO2. AICI3. [Fe(CN)ep. 1.8.1.4.3. Гибридная связь Это связь, устанавливающаяся с помощью образования гибридных эквивалентных орбит, которые являются комбинациями орбит 5, р и/или d. Существуют различные типы гибридизации в зависимости от природы и количества скрещиваю1цихся орбит. Пример; тетрагональная шбридизация SfP в случае метана СН4. Орбиты sfp получаются как комбинация одной орбиты 2s и трех чистых орбит Зр: - в фундаментальном состоянии электронная структура углерода имеет вид: лг2{ т QD ггпт РхРуР, - в состоянии гибридизации в результате скрещивания орбит 2s и 2р углерод имеет четыре эквивалентных орбиты: 1s4 орбиты sp* И 1111 И П Is 4 орбиты sp* Молекула метана образована перекрытием четырех гибридных орбит (sp) углерода с орбитами 1S атома водорода. Четыре связи С-Н эквивалентны и ориентированы к вершинам правильного тетраэдра. 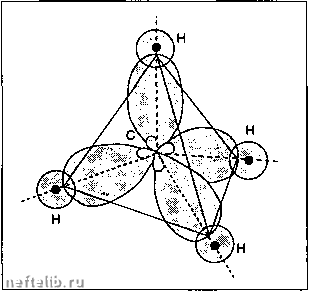 Молекула метана. 1.8.2. Химическая термодинамика 1.8.2.1. Определения Системой является часть пространства, отделенная от внешней среды фаницей, которая может быть как реальной, так и фиктивной. Система может быть гомогенной или гетерогенной в зависимости от того, содержит ли она одну, либо несколько фаз. В замкнутой системе возможен обмен с внешней средой теплом и работой; если же система обменивается и массой, то она называется открытой. В изолированной системе отсутствует обмен любой формой энергии с внешней средой. Для описания состояния системы используют две фуппы переменных состояния: - экстенсивные переменные, зависящие от количества вещества (массы, объема и т.д.). - интенсивные переменные, не зависящие от протяженности системы, такие как давление, температура, плотность. Система находится в состоянии равновесия, если ее свойства не претерпевают резких изменений во времени. 1.8.2.2. Мольные величины Для системы, состоящей из р компонентов, общее число молей (л) равно: n = f л, 1 где л, есть число молей i-ro компонента. Мольная доля х, определяется соотношением: X, = -, причем 2,х, = 1 Величина х, является интенсивной. В смеси на мольные свойства отдельного компонента влияют другие компоненты. По определению парциальной мольной величиной X/, соответствующей экстенсивной величине X, является частная производная от X по числу молей л, i-ro компонента при постоянных значениях других переменных. Эта величина является интенсивной: V гЭХп Л; = при этом: X = Хл,Х, Пример: рря смеси нескольких компонентов, занимающей обг>ем V, имеет место: V = In,V, причем: -3V--3"Jt.p. Пусть для чистых веществ их мольные объемы равны V?, Vj.....V°, тогда при выполнении свойства аддитивности объем смеси будет равен: V««. = In,V° В общем случае V отличается от Videail так например, для смеси воды с метанолом в пропорции 3 моли воды к одной моли спирта можно наблюдать сокращение объема: V-V. = 3.4% Meal 1.8.2.3. Термодинамические функции (См. § 1.7.1. и 1.7.2.).
Величины термодинамических характеристик некоторых элементов и соединений, представляющих интерес в газовой промышпетюсти (согласно Barin и Кпаскв). 1.8.2.4. Термодинамические функции простых веществ (См. §1.7.2.). 1.8.2.4.1. Химический потенциал совершенного газа Для одной моли совериюнного газа уравнение состояния может быть записано в форме: Если подставить это выражение в уршнение, описывающее изменение химического потенциала ц в зависимости от давления, то можно получить: IKJ.P) = ji(To.Po) + RT 1п если Ро = 1 атм или 1013 25 Па, то ц(Т, Pq) обозначается через и называется стандартным химическим потенциалом. Если выразить давление в паскалях, то выражение для химического потенцигта может быть записано в форме: ц(Т.Р) = j4 + RTIn Р, [PI = Па 1.8.2.4.2. Химический потенциал реального газа Введение новой функции (/), называемой фуги-тивностью, позволяет сохранить для химического потенцигта ту же форму, что и в случае совершенного газа: давлении 101 325 Па (1 атм), если бы он был совершенным; в этом случае /о > 1. Кроме топэ для реальных газов вводится коэффициент фугитивности (ф), такой что: Чем ближе газ к совершенному, тем ближе ф к единице, то есть: Нтф = lim - = 1 Для реального газа уравнение состояния можно записать в виде: PV-ZRT где Z является коэффициентом сжимаемости данного газа. Кроме этого имеет место: In / = JvdP Из этих двух соотношений легко показать, что: 1.8.2.5. Термодинамические функции газовых смесей H(T.P) = ? + RT \nj - химический потенциал, который соответствовал бы данному газу при заданной температуре и 1.8J2.5.1. Смесь совершенных газов Парциальным давлением Р, Аго компонента в смеси л„ л,л, молей совершенных газов, занимающих объем V при температуре Т, называется 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 [ 36 ] 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |