
 |
|
|
Главная Переработка нефти и газа Фазовая диаграмма в координатах Р, V: С - критическая точка, Т-тройная точка, Р» Vc То - координаты критической точки. Для критической изотермы кр)пическая точка является точкой перегиба 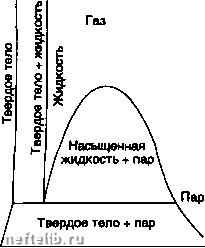 Фазовая диаграмма чистого вещества в координатах Р, V. 1.7.2.2.1.3.2. Смеси Фазовая диаграмма (координаты Р, Т). Дмлмм 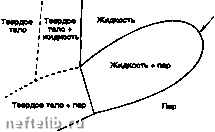 Критичаская точка Фазовая farpaMMB (общий случай). 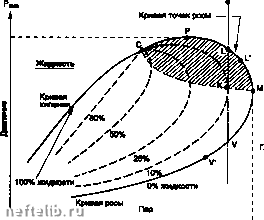 Тампаратура Облмтк ратросралиой H0HAM««4»ai Фазовая диаграмма (равновесие жидкость-пар для природного газа). В критической точке сходятся кривые постоянного содержания жидкой фазы (/« const) в двухфазной области жидкость + пар; кривая росы соответствует началу конденсации (/ж о), кривая кипений - появлению паровой фазы (/ж 1). Произвольная точка росы (или точка кипения) определяется двумя координатами Р и Т. В частности, можно говорить о температуре точки росы при заданном давлении, или наоборот, о давлении точки росы при заданной температуре. Затемненная зона в двухфазной области «жи/-кость-пар» для природных газов называется зоной ретроградной конденсации; она соответствует увеличению количества жидкой фазы при изотермическом расширении либо при изобарическом нагревании. 1.7.2.2.1.3.3. Расчет фазовых равновесий Термодинамическая эволюция замкнутой системы при данных Р и Т описывается как: 8Q Л) = 8Q + 8W либо: (<*J + PdV-TdV-TdS)0 В случае равенства достигается состояние равновесия, то есть dU + PdV-TdSж((Ю)дт-0 (G - термодинамический потенциал). При выводе этого соотношения можно показать, что в условиях равновесия удельный (на один моль) термодинамический потенциал компонента одинаков в разных фазах, сосуществующих в системе:
или: ц; называется химическим потенциалом компонента / в фазе ф. Правило фаз. Оно вьпвкает из вышеприведенных соотношений и формулируется следующим образом: вариантность (число независимых интенсивных паэа-метров) гетерогенной системы, содержащей фаз, N компонентов и гхимических реакций, равна: Примеры: Равновесие жидкость-пар чистого вещества: I-l+2-2-1 если зафиксировать Р, тот однозначно определена (и наоборот). Равновесие жидкость-пар бинарной смеси: 1>2 + 2-2>2 можно фиксировать две переменные, например, температуру и давление, и получить состав фаз. Равновесие метана с гидратом метана: СН4(газ) + лН20(жидкость) = [СН4, nHjO} (та. тело). Вариантность трехфазной системы есть: и°3 + 2- 3-1ж1 если зафиксировать Р, можно получить значение Т (кривая гидратообразования). Химический потенциал вычисляется с помощью соотношений: - для компонента в состоянии совершенного газа: цГ(Р.Т) = А[;;(Т) + ПТ1п(Р,) (flf - стандартный потенциал чистого компонента); - для компонента идеального раствора: 4р.Т) = gxP.T) + RT In (X,) {Xi- мольная доля жидкой фазы, jjf,- потенциал чистого компонента); - для компонента в реальном состоянии, в жидкой или паровой фазе: Ц/(Р.Т) = g°(T) + RT In (О (fi- фугитивность компонента). Фугитивность компонента / в паровой фазе вычисляется с помощью соотношения: где: ф," - коэффициент фугитивности, выводится с помощью уравнения состояния (см. § 1.7.2.2.1.2.7.). Фугитивность компонента / в жидкой фазе / вычисляется по уравнению состояния или с помощью эмпирических корреляций (Chao и Seader и др.) через активность а,=ул: 1 = уМ где: у, - коэффициент активности, X,-мольная доля, -фугитивность чистого компонента. Равновесие фаз описывается соотношениями (для N компонентов): = f, Исходя их этих уравнений вычисляются константы равновесия или коэффициенты распределения: 1.7.2.2.1.3.4. Расчет разделения фаз, точки кипения и точки росы Расчет разделения фаз дает ответ на следующий вопрос: при заданной смеси N компонентов, характеризуемой составом (л, рассматриваемой в условиях Р, Т, каково ее состояние (однофазное или многофазное), характеризуемое долей жидкой фазы, и каковы соответствующие составы различных фаз. В случае расчета точки кипения (/ -1) или точки росы (/ - 0) задаются суммарный состав и одна из двух переменных (Р или Т), а искомыми являются оставшаяся переменная (т или Р), а также состав зарождающейся фазы. Можно показать, что все расчеты сводятся к решению уравнения: лхь где: /- доля жидкой фазы, к,- константы равновесия, вычисляемые по уравнениям состояния. Решение строится итерациями, так как коэффициенты к, являются функциями Р, Т, X/, . Все расчеты выполняются с помощью программного обеспечения Газпак. На приведенном ниже рисунке показаны примеры фазовых диаграмм, вычисленных по уравнению Пенга-Робинсона. 80 - 80 ДшиМ1М«(бЦ>) 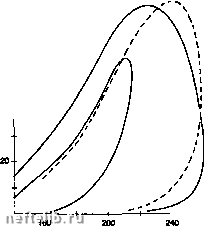 Т«т)«тум(Ю -1-1-- Криша cooTMTcnyi ---рахличным iMcTopo)! Огибающая фазовой диаграммы согласно уравнению Пенга-Робинсона. 1.7.2.2.2. Основные свойства компонентов газов распределительных сетей Основнью компоненты потребляемых газов (природный газ, смеси пропан-воздух, бутан-воздух и др.) представлены в следующей таблице. Даются следующие характеристики: - молекулярная масса [г/моль], Рс - критическое давление (бар). Тс - критическая температура (К), Ze - критический коэффициент сжимаемости, Ть - температура (К) выкипания при Р = 1 атм (= 101,325 кПа), (О - ацентрический фактор, Z(P, Т) - коэффициент сжимаемости в нормальных условиях Ро " 101,325 кПа, То = 273,15К, р(Р, Т) - плотность реального газа в нормальных условиях (кг/мЗ), аЬ(Ро. То) - относительная плотность по воздуху реального газа в нормальных условиях, -АсН(То) - теплота сгорания одной моли при 0°С (энтальпия сгорания при То = = 273,15 К) компонента в совершенном состоянии (кДж/моль), -ЛсН(Ро, То) - теплота сгорания одной моли при 1 атм (То = 273.15 К, Ро = = 101,325 кПа) компонента в реальном состоянии (кДж/моль), PCS(Po, То) - высшая теплота сгорания единицы объема компонента в реальном состоянии (кВт ч/мЗ(н)). Условия горения: 0°С и 101,325 кПа, условия измерения объемов: 0°С и 101,325 кПа Стандартный состав воздуха (мольные проценты): азот : 78,102 кислород : 20,946 аргон : 0,916 углекислота: 0,033 неон : 0,0018 гелий : 0,0005 + следы элементов: СН4, Кг, NO, СО, Хе. 1.7.2.2.3. Коэффициент сжимаемости, плотность и относительная плотность 1.7.2.2.3.1. В газообразном состоянии Коэффициент сжимаемости определяется из любого уравнения состояния ДР, V, Т, = О (см. §1.7.2.2.1), какг = Р(Р, Т,х,). Плотность вычисляется как: Р(Р.Т) = (Р.Т) М - молекулярная масса, М = ]£х,М, (г/моль). V(P, Т) - мольный объем (м/моль) в условиях (Р, Т). V(P,T) = Z(P, T)VO(P,T) здесь V°(P, Т)= - мольный объем совершенного газа в условиях (Р, Т). Относительная плотность есть отношение плотности рассматриваемого газа к плотности воздуха при тех же условиях (Р, Т). с«(Р.Т) = (р)р.т/(р«эд)р.т Обычно используют нормальную плотность do = = d(Po, То), то есть плотность, соответствующую условиям, называемым нормальными. Так, во Франции: Ро = 101,325 кПа, То = 273,15 К (но существует много других общепринятых стандартных условий за границей, поэтому относительная плотность чувствительно варьируется в зависимости от давления и температуры). Для вычисления коэффициента сжимаемости использовалось и используется до сих пор множество уравнений, в частности, уравнения Бенедик-та-Вебба-Рубина и Редлиха-Квонга (RK2-GDF), либо принцип соответственных состояний. Параллельно были разработаны специальные эмпирические методы (AGA-NX19 с коррекцией BRK0RR3H) и более поздние методики AGA8 и GERG. 1.7.2.2.3.1.1. Методика AGA-NX19 Она определяет величину F = - (коэффициент сверхсжимаемости) используя данные: % N2, % СО2, относительную плотность: Z - коэффициент сжимаемости в условиях Р, Т; Zf - коэффициент сжимаемости в стандартных условиях (f = бСР = 15,6С, Р = 101,59 кПа). Учитывая погрешность методики (в среднем, от 0,5 до 1% для природного газа), можно принять, что Рр = 7i7z. 1.7.2.2.3.1.2 Коррекция BRKORR3H Это есть поправка, вносимая в результат расчетов по методу AGA-NX19, имеющая вид: Zbrkor = ZagaII + F(P, Т, d. PCS, % C02] Поправочный член является полиномиальной функцией: давления, температуры, нормальной относительной плотности, теплоты сгорания и содержания углекислого газа. В среднем погрешность этих методов составляет от 0,25 до1% для природного газа при О < f < 40°С и Р < 80 бар. Недавно появились две новью методики, использующие уравнения состояния вириального типа 1.7.2.2.3.1.3. Методика AGA8 (GRI-OU) Разработана в США (Университет Оклахомы) для института исследований газа, использует уравнение Старлинга: Z = 1 + Bp + Ср2 + Dp3 + Ер5 + + А,р=(1+А2Рехр(-Агр2) где коэффициенты А,, Аг, В, С, D, Е являются функциями температуры, состава и параметров молекул (энергии, размеров и др.). Применяются специальные правила смешения. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 [ 29 ] 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
||||||||||
 |
 |