
 |
|
|
Главная Переработка нефти и газа 50 атм. 5 атм. 1 атм. 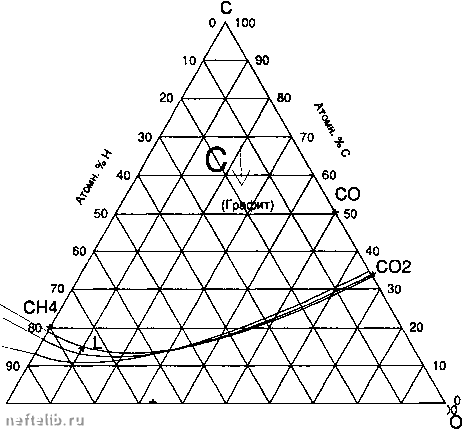 10 20 30 40 50 60 70 80 90 К Атомн. % О Тройная диаграмма С-Н-О при Т - 800 К (а- точка характерная для газа синтеза типа Луржи)
Влияние давления на равновесный состав газа синтеза типа Луржи при t - 800 К следующей таблице. Эта точка находится над граничными кривыми, соответствующими твмпера-туре 800 К и давлениям от 1 до 5 бар. Как видно, в этих условиях существует возможность образования свободного углерода, на что указывают равновесные составы С-Н-О, рассчитанные для давлений, заключенных между 1 и 50 бар. Практически, чтобы избежать образования свободного углв-рода, надо достичь давления в 30 бар. Ко всему прочему, увеличение давления в условиях равновесия способствует образованию метана. 1.8.2.8. ЭЛЕКТРОЛИТЫ 1.8.2.8.1. Определение Электролиты диссоциируются на ионы: - полностью (сильные электролиты; примеры: водныв растворы NaOH, NaCI; расплавы карюо-натов или хлоридов щелочных металлов); - частично (слабые электролиты; примеры: кон-центриров)анные водные растворы уксусной кислоты; чистая вода). Степень ионизации определяется следующим образом: число диссоциированных молей " число введенных молей - для сильного электролита: а = 1; - для слабого электролита: а < 1. Закон разбавления Оствальда: при сильном разбавлении слабые электролиты являются диссоциированными полностью (а -- 1). 1.8.2.8.2. Активность 1.8.2.8.2.1. Определение Вместо мольных долей используют концентрации (моль/л). Электролит может рассматриваться: - либо глобально - как обычное растворенное вещество в смеси с растворителем (например, случай водных растворов). Стандартным является описание типа закона Генри: Hz = Цг °9 Яг вг = Cz есл И Cz -»- О - либо с учетом ионов, образующихся в резульга-те диссоциации: МоХр *=i аМ + рх ар = [in (нейтральность) Примеры: CaClz Са*-н 2CI- а=1 р = 2 р = 2 п = 1 Маг304 5=!. 2Na* н-SO4" a = 2p=ip = 1 п = 2 Для ионов стандартным является также состояние, удовлетворяющее закону типа Г енри: = ц° -н RT log (а.)» у.С, = а. -- С„ если С. - О ц. = ц° + RT log (а.)Р у.С = а. -»- С, если С. -- О Принимают: ац! + РЦ- = Цг тем, чтобы: az = (аХ(а.) 1.8.2.8.2.2. Расчет средней активности 1.8.2.8.2.2.1. Определения Средняя активность: Средний коэффициент активности: Средняя мольная доля ионов: С, = *h0У(C.) Пример: S04Naz в водном растворе диссоциирует полно- стью: а= 1 3 = 2 С = = о, 795 2 а± = ytCt 1.8.2.8.2.2.2. Расчет коэффициентов у Упрощенный закон Дебаля-Хюкеля (Debye-Huckel): при малых концентрациях (полностью диссоциированный электролит): log 10 = - ВрТц log 10 Y. = - BnTjI log 10 Y± = - BnpTlI В = 0.504 в воде при 20°С, р = величина заряда ионов -ь, п = величина заряда ионов -, ц = CyZf = ионная сила раствора, С, - число ионов, г/л; Z/ - величина заряда (р или п). Пммерыг. - Активность HCI, с= 0.01 моль/л р=1 а=1 п=1 р=1 ц = J [0,01 X (1)40,01 X (I)""] =0,01 log 10 Y. = log 10 Y. = - 0. 5047o7oT = - 0, 050 4 y. = y. = 0.89 ан = aci = 0.0089 a = -0.0089 - Активность NiClz, с = 0.01 моль/л p=2 a=1 n=1 p=2 ц = [0,01 X (1)4 0,02X (I)""] =0,03 logio Y. = - 0,504x (2)470,03 = - 0,34 У . = 0,43 logio Y- = - 0,504x (1)4 70, 03 = - 0,085 Y = 0,81 logio Y± = - 0,504x1 x2x70703 = - 0,17 y,=0,67 C. = 0,02 C, = 0, 01 C± = V(o7o2)4o,01 =0,015 8 a± = Y±C± = 0.67 X 0.015 8 = 0.010 6 Активность HCI в растворе 0.01 моль/л HCI и 0.01 моль/л NiClz С.. = О, 01 Cq = О, 03 Сн = 0,01 ц = 1 [0,01 X (2)4о,ОЗх (1)4 н-0,01 X (I)""] =0,03 logio Ус, = - о, 504х (1) X vO, 04 = - 0,1 Ус = 0,80 logio /н =- 0,504х (1)4 Д04 = - О, 1 Yh = 0.80 CtHCi = VoToi хО. 03 = О, 017 а±нс1 = 0.017x0,80 = 0,013 6
1.8.2.8.3. Ионное произведение воды, рН HjO н* + он- н-он- = К. и РКн,о = CoLogioKe По определению: рН = Со1од,оан (Символ "Colog" означает "контрлогарифм", то есть логарифм с обратным знаком (прим. перев.)) При малых значениях рН среда является кислой. 1.8.2.8.4. Кислотность, щелочность 1.8.2.8.4.1. Классическая теория Кислоты характеризуются способностью высвобождать протоны Н* А- + Н* Основания высвобождают ионы ОН*: NH4OH nh; + он- Для сильной кислоты АН при концентрации с моль/л: рН = -1од,о с (если У„. - 1) Для сильного основания ВОН при концентрации с моль/л: рН = 14 н- 1од,о с (если у В обоих случаях увеличение концентрации в 10 раз изменяет рН на единицу. Для слабой кислоты или слабого основания: АН А- + Н* logioKa+logioC = К, рН-- pK, = -log,oK, pH = lpK,-llog,oC ВОН в*- он- 1од,оКб + 1од,оС = Кь рН-14 + рКь = -1од,оКь рН = 14 - рКь+1од,оС Увеличение концентрации в 10 раз изменяет рН на 0.5. 1.8.2.8.4.2. Теория Бронстеда Кислота является веществом, способным высвобождать протоны Н*: АН А- + Н* НгО + NH; NH4OH + Н* Основанием является вещество, способное захватывать протоны: NH4OH + Н* = Более общая форма: NH; +НгО кислота + основание кислота + основание А + НгО В + Н* кислота основание основание кислота В + Н,0 кислота А + ОН кислота основание 1.8.2.8.4.3. Теория Льюиса Кислота действует как акцептор электронов, а основание - как донор электронов. 1.8.2.8.5. Буферные растворы. Аифотерные электролиты Водный раствор называется буферным, если его рН слабо меняется при добавлении кислоты или основания. Его можно получить как смесь слабой кислоты (АН) и ее соли (АХ*). В этом случае рН выражается как: рН = рКд + log аА" 10": рН = рКд при Эдн = аА". Пример: эквимолекулярная смесь уксусной кислоты (СО3СООН) и ацетата натрия (CHgCOONa). Поликислоты. поликислоты способны высвобождать несколько протонов. Например, для H2S возможны следующие равновесные последовательные реакции: (1) Нг8 = HS + Н* рКаг = 7.0 (2) HS = + Н* рКа, = 12.9 HS~ называется амфолитом, так как он может играть роль и основания (равновесие 1), и кислоты (равновесие 2). Для раствора амфолита его рН не зависит от концентрации: рН = (рКа, + рКаг) Для раствора HS имеет место: рН = 1(12,9 + 7,0) = 9,95 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 [ 40 ] 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |