
 |
|
|
Главная Переработка нефти и газа Эти соотношения можно применять, если использовать уравнение состояния /(Р, V, Т) = О (см. §1.7.2.1. и 1.7.2.2.). 1.7.1.4. Термодинамические диаграммы 1.7.1.4.1. Диаграмма P-V (Клапейрона) При обратимом п представляет собой площадь под кривой внешних сил; при цик- лическом процессе работа, совершаемая флюидом, равна площади внутри контура; цикл соответствует работе двигателя, если направление обхода отрицательно (по ходу часовой стрелки).
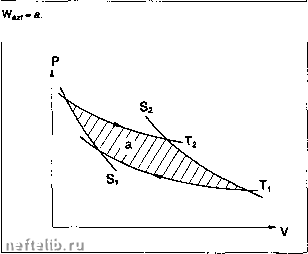 1.7.1.4.2. Диаграмма T-S (энтропийная) Обратимый цикл Карно изображается прямоугольником; его площадь равна количеству полученного тепла: О = jjdS но если процесс необратим, то: TdS- T5,S < площади
Обратимый цикл Карно. 1.7.1.4.3. Диаграмма H-S (Мольера) Часто используется для адиабатических превращений (компрессоры, турбины), в которых она позволяет показать степень необратимости, характеризуемую отношением: "rev которое называется "изэнтропический к.п.д.". 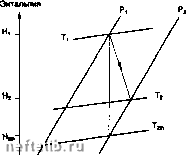 Энтропия Компрессор: г\ = ---. Энтальпия н, - 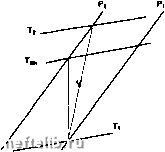 Энтропия Турбина: г\ =---. Абсолютное дмленив (бор) 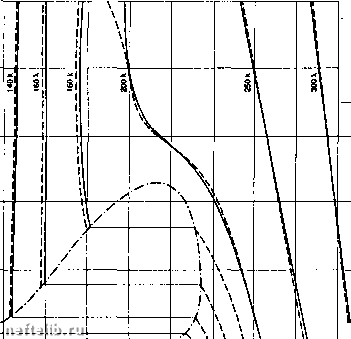 Начало координат: матаи при идмл» услоаиях (0*К - О бар) Н* О кДж/кг Данныа Загоручанко Иэотариа, рассчитанн по ураананию Радлиха-Каонга ----Криаая насыщания 100 200 300 400 500 600 700 800 900 1000 Знталынп (кДж/кг) Энтальпийная диаграмма метана. 1.7.1.4.4. Диаграмма Р-Н (энтальпийная) Очень удобна для представления изобарических превращений: количество теплоты в обменном процессе непосредственно считывается с оси абсцисс: clH = 8Q 1.7.2. Свойства газов 1.7.2.1. Модель идеального газа 1.7.2.1.1. Уравнение состояния Совершенным газом является особый гипотетический флюид, свойства которого строго удовлетворяют экспериментальным законам, исторически связанным с именами Бойля, Мариотта, Шарля и Гей-Люссака: PV = const при постоянной температуре в, V = Vo(1 + сс9) при постоянном давлении, в - температура в градусах Цельсия, Vq - объем при 0°С, Р ж Ро(1 + ре) при постоянном объеме, Ро - давление при О К, где а и р стремятся соответственно к а" и р°, когда плотность стремится к О, при этом: „ = 273,15С Если определить термодинамическую температуру Т (или абсолютную температуру) как: Т = в + то легко показать, что комплекс инвариантен для фиксированной порции газа. Тогда для одной моли газа (1 моль « N молекулам, где N - число Авогадро) можно получить: где: R - универсальная постоянная для совершенных газов R = 8,314 45 Дж • моль- • К-; Р - абсолютное давление (Па); Т - абсолютная температура (К); V - мольный объем (м • моль*). Для п молей газа, занимающих некоторый объем V: PV = лПТ или иначе, для массы m газа с молекулярной массой М (кг моль-) в некотором объеме V: PV = RT М Физически, модель совершенного газа подразумевает отсутствие всякого взаимодействия между молекулами в газе; она позволяет легко оценивать приближенно свойства газа при малых давлениях и высоких температурах (вдали от критической точки и от области фазового перехода). 1.7.2.1.2. Термодинамические свойства совершенных газов Использование уравнения состояния совершенных газов в соотношениях § 1.7.1.3.3 приводит к следующим свойствам совершенных газов. 1.7.2.1.2.1. Соотношение Клапейрона I ж р и Л = -V удельные теплоемкости совер- шенногр (обозначенные
через С, и ) являются функциями только температуры 1.7.2.1.2.2. Соотношение Майера C°-C° = R 1.7.2.1.2.3. функции состояния (А) = C°cfT dh = СрСГТ 1.7.2.1.2.4. Законы Джоуля Законы Джоуля выводятся из последних соотношений, устанавливающих, что внутренняя энергия и энтальпия совершенного газа зависят только от температуры. В итоге, термодинамические свойства могут быть вычислены с помощью соотношений: Н(Т)-Н°(То) = cldt S°(Po.T)-S(Po,To) = 1т J dP Г Р - = - R In Р iPo Существуют многочисленные таблицы основных свойств различных веществ( С", 1-1(Т) и т.д.) в совершенном состоянии. Чтобы полностью определить И°(Т) и S(P,T), надо зафиксировать величину постоянных 1-1°(То) и S°(Po,To): широко распространено следующее допущение: Н°(То) = О S(Po.To) = 0 для совершенного газа при Го = 0 К и Ро = 0.1 МПа (или 1 атм) Однако эти соглашения не являются универсальными, поэтому прежде, чем пользоваться различными таблицами, необходимо убедиться в соответствии принятых соглашений. Пример одной из таблиц дан ниже. На основе данных, взятых из таблицы, может быть рассчитано любое другое свойство с помощью установленных ранее соотношений: C: = C°-R иО(Т) = И°(Т) - RT go(P, Т) = НО(Р, Т) - TS»(P, Т) и в частности: gV.O-GVo.T) = RT In и т.д. 1.7.2.1.3. Приложение: цикл Карно совершенного газа Такой цикл состоит из двух изотерм и двух адиабат.
Цикл Карно. 1.7.2.1.3.1. Адиабатический процесс ds = o=.c:cl = o либо.заменяя величины С° и С° своими средними постоянными значениями и интегрируя: либо PV = const, где Y = Р Т = const 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 [ 26 ] 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |