
 |
|
|
Главная Переработка нефти и газа давление, которое имел бы этот газ, если бы находился один в объеме V при той же температуре; таким образом, выполняется: Ру.лЛТ (см. §1.7.2.1.4.) причем: Р, = Р = х,Р Общее давление смеси равно сумме парциальных давлений (зжон Дальтона): Р = 1Р, Химический потенциал i-ro компонента задается как: = цо + рт In 1, р, > Р,), то несложно если стандартным является состояние совершенного газа в чистом виде, то Р° -= 1, откуда: H, = nf+RT In Р, 1.8.2.5.2. Смесь реальных газов Общее выражение для химического потенциала компонента / в смеси реальных газов имеет следующий вид: H, = H? + RT In I где f, играет такую же роль, как Р, для совершенных газов. Если принять в качестве стандартного состояние совершенного газа при 101 325 Па, когда -= /ч 1, то выражение для ц, примет вид: H, = H° + RT In f, Помимо этого можно определить коэффициент фугитивности (ф для каждого компонента, так что: Ф; = . причем тф,= 1 1.8.2.6. Растворы 1.8.2.6.1. Идеальные растворы (закон Рауля) Химический потенциал компонента / в м/цаапь-ном растворе задается в виде: где ц, является химическим потенциалом в стандартном состоянии, которое соответствует чистому компоненту (Х/> 1). Для идеального раствора, находящегося в равновесии со своим паром, химический потенциал каждого компонента в обеих фазах одинаков, то есть: и далее: lil + rj In X, = \i]° + rj In Если принять для обеих фаз одно и то же стандартное состояние, например, соответствующее чистому веществу {х, вывести закон Рауля: Р,«Р>/ В идеальной смеси парцигтьное давление пара (Р1) произвольного компонента пропорционально его мольной доле в жидкой фазе, причем коэффициент пропорциональности равен давлению пара чистого компонента при рассматриваемой температуре. Рисунок, представленный ниже, демонстрирует линейные изменения парциальных давлении (Р, и Рг) в зависимости от состава бинарной идеальной смеси. T-oorat 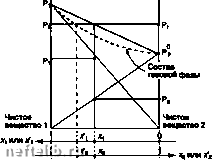 Идоальная бинарная смесь. 1.8.2.6.2. Разбавленные растворы (закон Генри) Разбавленным является раствор, в котором содержание одного компонента очень близко к 1 (х, «• 1) - этот компонент является растворителем, а содержание других компонентов, являющихся 1НЫМИ веществами, очень близко к нулю. 1 таком растворе давление паров го растворенного вещества пропорционально его мольной доле х). Коэффициент пропорциональности (1(н)/ (коэффициент Генри) зависит только от температуры и от природы растворителя: Р/СУЛ; при X,--О Это есть формулировка закона Генри. Он может применяться и для газа, растворенного в слаболетучей жидкости, тогда его давление в паровой фазе пропорционально его мольной концентрации в растворе. Для реальной бинарной смеси при малых концентрациях растворенного вещества растворитель подчиняется зжону Рауля, а растворенное вещество - зжону Генри. Разбавленный раствор близок по свойствам к идеальному раствору, причем их сходство тем больше, чем больше степень разбавления. 1.8.2.6.3. Реальные растворы. Понятие активности В концентрированных растворах вместо мольных концентраций (xj вводят новую величину (ai, называемую активностью, такую что: ц, = ц; RT In а, Xi или Х*) - 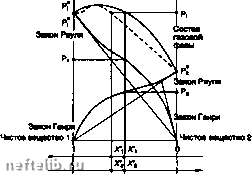 или Xf Реальная бинарная смесь. Выбор стандартных условий произволен, каждому из них соответствуют свои значения Обычно за стандартное принимается состояние чистого вещества, играющего роль растворителя. В этом случае имеем: причем: lim (у =1, Y/ - коэффициент активности, отражающий степень отклонения от идеального состояния. При принятых соглашениях активность любого А го компонента равна отношению давления его пара (Р в растворе к давлению его пара в чистом состоянии ( Р°) Для растворенного вещества более удобно в качестве стандартного взять состояние компонента в бесконечно разбавленном растворе. В этом слу- ТОО пмиим. причем Нт(Г,) = 1 Можно показать при этом, что а) = (*н), (/у, - константа Генри Акомпонента, которая может быть оценена по углу наклона кривой: Р,-= ЦхЦ прих, 1.8.2.7. Равновесие 1.8.2.7.1. Условия равновесия и эволюции термодинамической системы Любое превращение в системе при постоянных температуре и давлении (фазовый переход или химическая реакция) обязательно сопровождается уменьшением термодинамического потенциала. Необходимым условием для того, чтобы произошло самопроизвольное превращение, является следующее: сЮт.р<0 Превращения будут происходить тем легче, чем значительнее понижение термодинамического потенциала. Система находится в равновесии, когда ее термодинамический потенциал минимален, то есть: dGr.poO Различают устойчивое или неустойчивое равновесие в зависимости от того, положительным или отрицательным является cG. 1.8.2.7.2. Правило фаз Гиббса Вариантностью (v) или числом степеней свободы произвольной системы называется количество независимых интенсивных величин, фиксированные значения которых определяют состояние системы: v-(JH-i) + 2- (N-/)-число независимых компонентов: равно разности общего числа компонентов N и числа независимых связей г, существующих межу ними (химические реакции или связи между концентрациями); ф - число фаз; газы, однородные жидкие или твердые растворы пре/ютавляют одну фазу; твердые тела разной природы являются различными фазами. Инвариантная система (i 0) может существовать только при заданных температуре и давлении. В моновариа»ггной системе (i = 1) можно варьировать одним из равновесных параметров, сохраняя при этом состояние равновесия. Если система дивариантна, то при постоянных температуре и давлении состав ее фаз фиксирован. Пример: реакция дисмутации СО (реакция Будуара): 2С0 3=t с + СОг Система состоит из двух фаз (газ и твердое тело), трех компонентов (N 3), связанных одной реакцией (г = 1). Правило фаз показывает, что система дивариантна: «=(3-1) + 2-2 = 2 1.8.2.7.3. Равновесие чистых аеществ Чистое вещество в однофазном виде: газообразном, жидком или твердом, представляет собой дивариантную систему (i-: 2). Для определения ее состояния необходимо зафиксировать давление и температуру. Если в равновесии находятся две фазы одного вещества, система моновариантна (i 1). Если зафиксировать давление, то температура однозначно определяется. Связь между этими переменными дается уравнением Клапейрона: ДН TAV АН - скрытая теплота изменения состояния, AV - разница мольных объемов двух фаз. При равновесии жидкость-пар (испарение) мольный объем жидкой фазы (Vj пренебрежимо мал по сравнению с мольным объемом пара (V. Если считать, что пар является насыщенным совершенным газом, можно получить: AV = V,-V,-V,= - В этом случае уравнение Клапейрона можно записать как: e/ln Р ДН, (уравнение Клаузиуса-Клайперона)
Фаэовт днагрешша чистого вещества. Кривые Р /ГП сублимации (равновесие "твердое тело-пар") и испарения имеют близкий наклон, кривая, относящаяся к плавлению (равновесие "твердое тело-жидкость"), очень близка к верти- кали, так как при очень малых AV величина - становится очень большой. Система, рассматриваемая как чистое вещество одновременно в трех своих состояниях, является инвариантной (i 0). Она соответствует точке пересечения трех кривых, которая называется тройной точкой. Для метана тройная точка соответствует Т » -182°С и Р « 11,1 кПа, для воды: Т -= .-0.0075°СиР.610Па. Если чистое вещество в твердом состоянии может быть представлено несколькими аллотропными модификациями (твердые фазы с различной кристаллической структурой), то фазовая диаграмма имеет несколько тi}oйныx точек. Для серы существует две разновидности: Sa (октаэдричес-кая или ромбическая сера) и Sp (призматическая или моноклинная сера); диаграмма Р > содержит четыре тройные точки (см. следующий рисунок).
Фазовая >}иа/рамма серы. 1.8.2.7.4. Химическое равновесие Стехиометрическое уравнение химической реакции для компонентов а/ может бьпъ записано в виде: IvA = О V, - стехиометрический коэффициент компонента он отрицателен для исходных реагентов и положителен для продуктов реакции. Приращение числа молей (с/л различных компонентов подчиняется закону заданных пропорций: Переменная характеризует полноту протекания реакции. Пример: реакция конверсии газа синтеза: СО + ЗНг СН4 + HjO Имеем: vco-=-1 . Уц = -3. VcH, - а также: dnco dn dricH dnja 1.8.2.7.4.1. Энтальпия и энергия Гиббса химической реакции Энтальпия реакции равна количеству тепла, отданного или полученного системой при постоянном давлении. Теплота реакции при одной атмосфере называется стандартной и обозначается как АН°. Она определяется с помощью стандартных мольных энтальпий компонентов реакции (/>?): АН° = ХуЛ?), - Если АНт < О, то реакция является экзотермической и сопровождается выделением тепла. - Если АН? > О, реакция является эндотермической и для ее протекания необходимо подвести энергию. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 [ 37 ] 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |