
 |
|
|
Главная Переработка нефти и газа Фактически, уравнение будет определено лишь после того, как для каждого компонента будут установлены параметры (аа), и Ь/, а также введены коэффициенты парного взаимодействия kf для смесей. 1.7.2.2.1.1.2. Принцип соответственных состояний Представление (см. выше) уравнения Ван-дер-Ваальса в приведенной форме (это можно проделать и с другими уравнениями) позволяет установить, что в принципе для любого вещества оказывается применимым одно единое соотношение, содержащее только безразмерные величины: /[P„V„T,) = 0 (на следующем рисунке один общий график). В связи с этим, если два газа находятся в таких состояниях, что по две их приведенных переменных равны, то эти состояния называются соответ- ственными: третья приведенная переменная у этих газов также оказывается одинаковой. Однако обычно такой подход оказывается недостаточным для описания явлений, в связи с чем делались попытки включить в уравнение и другие параметры: /[Р„ V„ Т„ а,...) = 0. Так, Питцером (Pitzer) был введен ацентрический фактор ш -р при Т,. == 0,7, который является "мерой" »«(/ степени различия в поведении молекул газа и простых сферических молекул (для аргона со == 0,00). Уравнения в форме: Z = Z«» + (oZW + (o2ZP) + ... были предложены (Pitzer, Lee-Kesler), чтобы выразить PVT-свойства газа и другие величины (Н, Ср и др.): члены Z , Z(>, ... являются функциями приведенных переменных Р„ Т,. Р, Приведенное давление 0.2 0.3 0.4 0.5 0.6 0.6 1.0 2.0 3.0 4.0 5.0 6.0 6.0 10.0 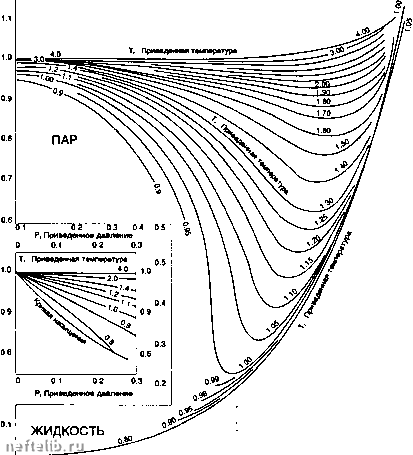 Источник: Pitzer К.В. et al. - Journal о( , Chemical Sciences, 1977, p. 3427-3440 (61959) Ф (0 0.2 0.3 0.4 0.5 0.6 0.6 1.0 2.0 3.0 4.0 5.0 6.0 6.0 10.0 Pr Приведенное давление Принцип соответственных состояний: коэффицитт сжимаемости как функция приведенных координат. Приложение к смесям. Необходимо определить координаты критической точки для смеси. Было предложено несколько правил, наиболее распространенным является простое суммирование критических параметров компонентов с весом, равным мольной доле. Таким образом определяются псевдокритические параметры смесей: 1.7.2.2.1.1.3. Уравнения вириального типа Они имеют вид: PV , В С =RT = "vV- = = 1 +Вр + СрЧ... = 1 +ВР + СР+..., (RT) (RT) Эта формулировка вытекает из статистической механики, которая дает интерпретацию вириаль-ных коэффициентов: второй вириальный коэффи-цивнт(В) учитывает взаимодействие между двумя молекулами (парное соударение), третий - взаимодействие трех молекул и т.д. На практике для проведения вычислений ряд обрывают на 2-м, либо 3-м члене. Коэффициенты, являющиеся функциями температуры, определяются с помощью экспериментальных корреляций (Pitzer-Curl: В = В™ + ооВ*)), либо могут быть оценены с помощью соотношений для потенциалов меж-молекулярного взаимодействия. Другие, часто используемые для газа уравнения, родственны к вириальным, но содержат дополнительно последний член, описывающий поведение отброшенного остатка разложения. Уравнение Бенвдикта-Вебба-Рубина (Benedict-Webb-Rubin):
(1+Yp)pexp (- Yp") Уравнение Старлинга (Starling): Z = 1 + Во-Ао ( b-a RT RT d Л + a RT RT a RT RT (1+Yp)pexp (- Yp) В публикациях авторов можно найти значения коэффициентов для индивидуальных компонентов природного газа, а также правила смешения. Приведенные выше соотношения являются общими уравнениями, позволяющими оценить физические свойства газа. Существует множество других уравнений, некоторые из которых, имеющие специальное назначение, применяются и в газовой промышленности, например, для расчвта плотности жидкой фазы (сжиженного природного газа). 1.7.2.2.1.2. Расчет свойств газов Поскольку свойства газов в совершенном состоянии известны или легко вычисляются (см. §1.7.2.1), свойства реальных газов вычисляются следующим образом: М = М» + (М - М»), где второй член представляет собой разницу в свойстве М между реальным газом и данным газом в совершенном состоянии при тех же условиях (Р, Т): он называется отклонением и рассчитывается с помощыо уравнения состояния по соотношениям, приведенным в § 1.7.1.3.3. 1.7.2.2.1.2.1. Энтальпия Для энтальпии можно получить в итоге:
или, если ввести Z: И-И" = -R-f dP Р или же: H-H" = U-U" + RT(Z-1)=> Н-Н= RT" либо, используя уравнение состояния: Редлих-Квонг => Н - Н" = 7тda = RT Z-1 - (bRT) \2jj сП-Вириальное => Н- Н° = ( + ЬЛ = -R-f dT „dC +... "dT и т.д. Аналогично можно получить выражения для других свойств с помощью следующих соотношений. 1.7.2.2.1.2.2. Внутренняя энергия и - и» = RT(1 - Z) + Н - Н» 1.7.2.2.1.2.3. Удельная теплоемкость С -Cf = р = - RT - T(-V) dP =
dl F с„-с?= = RT d\f = RT/aZ 2R 13TJ ZRTl ZR RT -=- + -=- = - T 1.7.2.2.1.2.4. Энтропия 8-8° = 1-Z-r dP = dP Z-1 +T 3Z ЭТ dV-RIn Z = 1.7.2.2.1.2.5. Свободная энергия F-p.(U-U°)-T(8-8») 1.7.2.2.1.2.6. Потенциал Гиббса G-G>-(H-H0)-T(8-80) 1.7.2.2.1.2.7. Фугитивность Для расчетов фазового равновесия используется фугитивность /, определенная как: dG = RTd(ln f) при llm / = Р р-»0 Далее будет использоваться коэффициент фу-гитивности <р = , вычисляемый как: (V-)dP = = Z-1-ln Z + -RT . V 1.7.2.2.1.2.8. КоэффициентДжоуля-Томсона f.1 = (адиабатич) . Up Л -эт. Все эти соотношения могут использоваться совместно с уравнениями состояния, приведенными ранее. В распоряжении управления исследований и новой техники общества Таз де Франс имеются программы, осуществляющие расчет этих свойств, к примеру, в форме программного обеспечения Таз-пак* (Gaspack), выполненного в диалоговом виде, что делает его доступным для любого пользователя либо на терминале компьютера G.D.F., либо на дискетах для микрокалькулятора. 1.7.2.2.1.3. Фазовое равновесие 1.7.2.2.1.3.1. Чистые вещества Фазовая диагрсмма в координатах Р, Т: Т - тройная точка, С - критическая точка, кривая ТС - кривая давления насыщенного пара (или упругости насыщенного пара) над жидкостью. Критичаская точка
Для метана Тампаратура Тройная точка: Тт - 90,7 К (-1 в2.5*С) Рт-11,7кПа(0,117бар) Критичаская точка: Те - 190,5 К (-вг,в*С) Рс-4599 кПа (45,99 бар) Фазовая диаграмма чистого вещества в координвтах Р, Т. Соотношения Клапейрона: на кривой равновесия, например, на кривой испарения: АН =T(V,-V) AHvip - теплота испарения, V,, - мольный объем пара, V/ - мольный объем жидкости. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 [ 28 ] 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |