
 |
|
|
Главная Переработка нефти и газа
Рис. XXIIM. Зависимость теплового эффекта реакции каталитического крекинга легкого сырья q от глубины превращения х О 20 40 60 80 100 X, % (масс.) следует, что теплота реакции первоначально с возрастанием глубины превращения сырья увеличивается, а затем уменьшается; максимальное значение теплоты реакции соответствует глубине превращения сырья 55 %. ОСНОВЫ КИНЕТИКИ НЕФТЕХИМИЧЕСКИХ РЕАКЦИЙ. ОПРЕДЕЛЕНИЕ РЕАКЦИОННОГО ОБЪЕМА Важной характеристикой химического процесса является степень превращения (конверсии) исходного сырья, под которой понимают относительное количество исходного сырья, прореагировавшего в данной реакции, измеренное в долях единицы или процентах. Так, если степень превращения равна х, то количество непрореагировавшего сырья составит 1 - X, или 100 - X. Для осуществления любой химической реакции с заданной степенью превращения необходимо, чтобы в течение определенного времени участвующие в реакции вещества находились в реакторе при определенных температуре и давлении. Чем выше скорость химической реакции, тем меньше время, необходимое для ее осуществления, и тем меньше будет объем реактора. Под скоростью реакции подразумевают количество вновь образующихся продуктов в единицу времени. Для простейшей мономолекулярной гомогенной реакции скорость реакции определяется уравнением где К - коэффициент пропорциональности, носящий название константы скорости реакции. Из этого уравнения после интефирования имеем K=lln-1-. т 1-х Решив данное уравнение относительно продолжительности реакции т, получим к 1-х Для реакций других типов константы скорости реакций или время реагирования определяются другими, более сложными уравнениями или кинетическими кривыми. Если известна продолжительность реакции т, необходимая для осуществления данного химического процесса с заданной степенью превращения, то требуемый объем реакционного пространства Vp = VT/e, где V - объем реагирующих веществ при температуре и давлении реакции, м/с; т - продолжительность реакции, с; е - доля свободного объема реакционного пространства (для некаталитических процессов е = 1). Использование этого простого уравнения во многих случаях затруднительно. Для многих нефтехимических реакций не представляется возможным определить продолжительность реакции, и, кроме того, существенные затруднения представляет определение объема реагирующих веществ V. Многие реакции протекают со значительным изменением объема вследствие образования продуктов реакции, объем которых существенно отличается от объема исходных продуктов, поэтому для определения объема реагирующих веществ необходимо располагать зависимостью количества образующихся веществ от длительности реакции. Многие реакции протекают при высоких температурах и давлениях, поэтому осложняется определение объема газообразных и парообразных продуктов реакции, так как в этих условиях наблюдаются значительные отклонения от законов идеальных газов. Учитывая отмеченное, при расчете объема реакционных аппаратов используют экспериментально найденное значение объемной или массовой скорости. Объемная скорость есть производительность единицы реакционного объема, измеряемая для жидкого сырья как объем холодного сырья, подаваемого в 1 ч на единицу объема реакционной зоны. Эта величина выражается в mv(m4) или ч. При газообразном сырье объемная скорость выражается в кубометрюх исходного газа при нормальных условиях. Массовая скорость равна массе сырья, поступающего в 1 ч на единицу массы катализатора или теплоносителя, находящегося в зоне реакции. Единица измерения этой величины кг/(кг-ч) или ч. Отметим, что величина, обратная объемной (1/nJ или массовой скорости (1/п), пропорциональна длительности реакции и называется фиктивным временем реакции Тф. Так, если при неизменных прочих условиях объемная или массовая скорость увеличена в 2 раза, то продолжительность реакции уменьшается также в 2 раза, хотя абсолютное значение длительности реакции в обоих случаях остается неизвестным. С использованием объемной или массовой скорости объем реакционной зоны определяется по следующим уравнениям: Vp = К/п, = КТф; Vp = G,/n,p„ = С.Тф/р„. (XXIII.3) где Vc - объем исходного сырья, м/ч; G- масса исходного сырья, кг/ч; р„ - плотность слоя катализатора (теплоносителя) в реакторе, кг/м Как отмечалось ранее, для сложных химических процессов, отличающихся образованием ряда продуктов реакции, зависимость степени превращения и выходов продуктов реакции для данного сырья х, катализатора и температуры процесса от длительности реагирования представляют в виде кинетических кривых. в качестве примера на рис. XXIII-2 приведены кинетические кривые для каталитического газойля при конкретных условиях в зависимости от фиктивной длительности реагирования Тф = 1/п. В общем случае зависимость константы скорости химической реакции от температуры выражает уравнение Аррениуса: 1дК; = ---1- 1пС, (XXIII.4) где С - постоянная интегрирования; R - универсальная газовая постоянная; Т - температура процесса, К; Е - энергия активации. Энергией активации называют избыток энергии реагирующих молекул над средним значением энергии всех молекул реагирующей системы при данной температуре. Значение энергии активации определяется из уравнения (XXIII.4) на основании экспериментально найденной константы скорости реакции при двух температурах. Чем выше энергия активации, тем меньше скорость химической реакции. При осуществлении химической реакции в присутствии положительного катализатора энергия активации снижается, поэтому скорость реакции увеличивается. Этим и объясняется возможность понижения температуры процесса при осуществлении реакции в присутствии катализатора. Для ряда нефтехимических процессов значение энергии активации лежит в пределах 60 - 270 кДж/моль. Учитывая, что при повышении температуры скорость реакции возрастает, время, необходимое для осуществления реакции, соответственно сокращается. Так, если при температурах (, и (2 константы скорости реакции равны К, и Кг, то продолжительность реакции т, и Тг при этих температурах обратно пропорциональна константам скорости реакции, т.е. 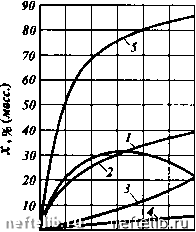 О 0,1 0,2 0,3 0,4 0,5 0,6 Гф,Ч Рис. XXIII-2. Кинетические кривые ступенчато-противоточного каталитического крекинга вакуумного газойля при 475 °С: 1 - бензин; 2 - легкий газойль; 3 - газ; 4 - кокс; 5 - глубина превращения 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 [ 207 ] 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |