
 |
|
|
Главная Переработка нефти и газа лах изменения концентрации в жидкой фазе от х, до Xj. За пределами этой области концентраций имеем гомогенный раствор, для которого равновесная концентрация в паровой фазе уже будет зависеть от состава жидкой фазы. Если пары, находящиеся в равновесии с двумя жидкими фазами составов X, и Xj, имеют равновесный состав х, < уд < Xj, то имеем дело с жидкостями, образующими кривые растворимости первого типа (эвтектический класс частично растворимых компонентов). В этом случае при некоторой концентрации жидкой фазы Хд в системе образуется азеотроп, определяющий температуру кипения смеси в интервале изменения концентраций X, - Xj. Типичные изобарные температурные кривые для жидкостей, имеющих кривые растворимости первого типа, приведены на рис. 11-20. К этому типу, например, относится система вода-фурфурол. При изменении концентрации компонента в жидкости от О до х, температура системы будет понижаться от t„ - температуры кипения ВКК до - температуры кипения азеотропа. Концентрация НКК в равновесных парах изменяется соответственно от О до Уд = Хд. В области концентраций исходного НКК от х, до х, образуются два ЖИДКИХ слоя, один из которых имеет концентрацию х,, а другой Xj. Температуры кипения всех жидкостей в указанном интервале концентраций будут оставаться равными t- При увеличении концентрации исходного НКК в смеси свыше Xj вновь образуется гомогенный раствор, а температура кипения смеси будет увеличиваться от до t„ при одновременном увеличении концентрации исходного НКК в равновесных парах. В этой области концентраций роль НКК перейдет к исходному ВКК. Для подобных систем кривая равновесия будет иметь вид, приведенный на рис. 11-21. 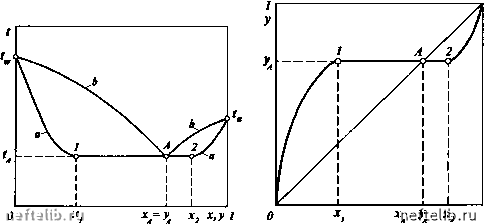 х,у1 Рис. 11-20. Изобарные температурные кривые для жидкостей, имеющих кривые растворимости первого типа: 1 - точка, соответствующая составу х, при температуре (д; 2 - то же, для х.; А - точка азеотропа Рис. 11-21. Кривая равновесия фаз для смесей, имеющих кривую растворимости первого типа: 1 - точка, соответствующая составу х, при составе паровой фазы уд,- 2 - то же, для Xjj А - точка азеотропа 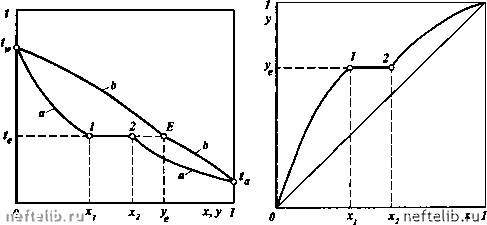 Рис. 11-22. Изобарные температурные кривые для жидкостей, имеющих кривые растворимости второго типа: 1 - точка, соответствующая составу х, при температуре 2 - то же, для х; Е - точка, соответствующая составу равновесных паров у. Рис. 11-23. Кривая равновесия фаз дл" ограниченно растворимых жидкостей второго типа: 1 - точка, соответствующая составу х, при составе паровой фазы у,; 2 - то же, для Xj Жидкости, у которых в гетерогенной области существования состав равновесного пара выходит за пределы концентраций х, - Xj, относятся ко второму типу (неэвтектический класс частично растворимых компонентов). Примером системы второго типа является смесь фенола и воды. На рис. 11-22 и 11-23 приведены соответственно изобарные температурные кривые и кривая равновесия фаз для этого типа жидкостей при Уе > х,, Xj. При изменении концентрации НКК от О до х, система будет однофазной. Температура системы будет уменьшаться от до t. Равновесные пары изменят свой состав от О до у (точка Е). В области составов смеси от х, до Xj температура кипения жидкости остается постоянной и равной t. Образовавшиеся две жидкие фазы имеют составы X, и Х2, а равновесные с этими жидкостями пары - состав у. Изменение концентрации НКК в пределах от Xj до 1 приведет к изменению температуры системы от tg до t„. Система будет иметь одну жидкую фазу, а состав паров будет изменяться от у до 1. Из приведенных данных следует, что состав равновесных паров смеси второго типа богаче НКК, чем жидкость. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ При рассмотрении равновесия практически взаимно нерастворимых жидкостей могут встретиться два случая: 1) оба компонента присутствуют и в паровой, и в жидкой фазах; 2) в жидкой фазе присутствует только один из компонентов. Первый случай отвечает состоянию системы, при котором пары обоих компонентов являются насыщенными, а в жидкости вследствие нерастворимости компонентов имеются две фазы. Примером такой системы является смесь углеводородов в присутствии насыщенного водяного пара. Согласно правилу фаз Гиббса, число степеней свободы такой системы I = 2 + 2-3 = 1, т. е. только один из параметров, характеризующих состояние такой системы (температура, давление, состав паровой фазы), может быть выбран произвольно. Соотношение между количествами фаз не оказывает влияния на состояние равновесия. Таким образом, достаточно, например, задаться температурой системы, чтобы определилось равновесное состояние, т.е. давление системы и состав паровой фазы. Во втором случае один из компонентов присутствует в виде перегретых паров, а жидкая фаза только одна. Примером такой системы может служить смесь углеводородов в присутствии перегретого водяного пара или инертного газа (азот, двуокись углерода и др.). Для такой системы число степеней свободы 1 = 2-1-2-2 = 2, т.е. из вышеупомянутых параметров, характеризующих состояние равновесной системы, произвольно могут быть выбраны два. В этом случае недостаточно знать только температуру; чтобы в условиях равновесия определился состав паровой фазы, необходимо также задать давление, а чтобы определить давление системы, надо назначить состав паровой фазы. Для взаимно нерастворимых жидкостей в случае, когда оба компонента присутствуют в жидкой фазе, давление системы при заданной температуре не зависит от соотношения масс жидких фаз и поэтому равно сумме давлений насыщенных паров компонентов, т.е. Рог =Ра+Рг =Ра +Р.- В соответствии с законом Дальтона, состав паровой фазы определится следующим образом Poz Ра+Рг у; =1-Уа =- = - (11.30) Рог Ра + Рг Для пересчета мольных концентраций паровой фазы в массовые используют следующее уравнение Уо=- G + Z N„M„ + N,M, yiM„+(l-yi)M, РаМ„+Р,М, J P,M, (11.31) P„M„ где M„ и - соответственно мольные массы компонентов а и z. Удельный массовый расход одного компонента по отношению к другому, например расход водяного пара Z, затрачиваемого на перегонку массы углеводородов G, определится следующим образом: £.ЬУ...("-°Ь. (11.32) Z у„ Р„А1„ Р„А1„ где л - внешнее давление системы. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 [ 25 ] 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 |
||
 |
 |