
 |
|
|
Главная Переработка нефти и газа РАВНОВЕСИЕ ПРИ ВЫСОКИХ ДАВЛЕНИЯХ Рассмотрим влияние повышения давления в системе на характерные кривые, описанные выше. Влияние давления на кривую равновесия фаз отражено на графике (рис. 11-12). С увеличением внешнего давления к кривая равновесия фаз становится менее выпуклой и приближается к диагонали диаграммы х - /, так как повышение давления уменьшает коэффициент относительной лету- 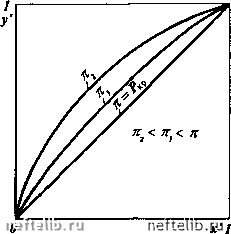 Рис. 11-12. Кривая равновесия фаз при разных давлениях А, Я 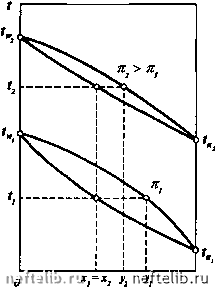 х,У 1 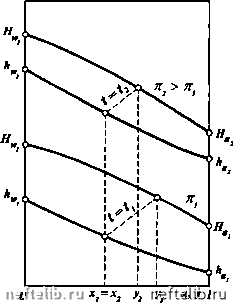 Рис. 11-13. Изобарные температурные кривые Рис. 11-14. Энтальпийные диаграммы при при разных давлениях разных давлениях чести а , что приводит к меньшему обогащению паровой фазы НКК. При критическом давлении Рр кривая равновесия фаз сольется с диагональю х = у и различие равновесных паровой и жидкой фаз исчезнет. Поэтому при проведении процессов с участием паровой и жидкой фаз внешнее давление должно быть возможно ниже критического. Обратимся к изобарным температурным кривым (рис. 11-13). При повышении давления, во-первых, повышается температура системы, во-вторых, кривые кипения и конденсации сближаются между собой, что так же связано с меньшим обогащением паровой фазы НКК. Аналогичным образом ведут себя и кривые на энтальпийной диаграмме (рис. 11-14). Кроме того, повышение давления системы может привести ее к отклонению от идеальности. Эти обстоятельства следует учитывать при расчетах процессов перегонки и ректификации и выборе рабочего давления в системе. РАВНОВЕСИЕ ДВУХКОМПОНЕНТНЫХ СИСТЕМ, ЧАСТИЧНО ОТКЛОНЯЮЩИХСЯ ОТ ЗАКОНА РАУЛЯ В отличие от идеальных растворов для двухкомпонентных систем, частично отклоняющихся от закона Рауля, парциальные давления компонентов и общее давление смеси при изменении концентрации изменяются не по прямой. Такие системы называются нормальными растворами. При этом смеси обладают положительным отклонением от закона Рауля, если парциальные давления и общее давление системы больше величин, вычисленных по закону Рауля. Если же парциальные давления компонентов и общее давление смеси оказываются меньше, чем для идеальных растворов, то такие смеси имеют отрицательное отклонение от закона Рауля. На рис. 11-15 приведены примеры подобных кривых в случае положительного и отрицательного отклонения от закона Рауля. Для подобных систем кривая равновесия фаз и изобарные температурные кривые имеют тот же вид, что и для идеальных растворов, т.е. в этих системах температуры кипящей жидкости и насыщенных паров непрерывно повышаются с уменьшением концентрации НКК в жидкости и паре. Кривая равновесия фаз смесей этого типа характеризуется тем, что концентрация НКК в паровой фазе всегда выше, чем в жидкости при любом составе жидкой фазы. Следовательно, кривая равновесия всегда выпуклая и не пересекает диагонали диаграммы х - /. Для рассматриваемых систем парциальные давления компонентов могут быть определены по уравнениям Ра =УЛх и = 7Л(1-х), где 7а и Y„ - коэффициенты активности соответственно НКК и ВКК. 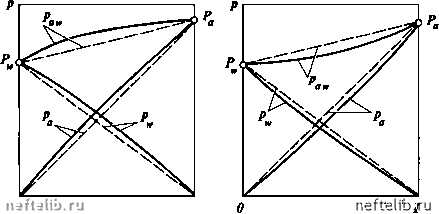 х\у 1 Рис. 11-15. Зависимость парциальных н общего давлений в системе, частично отклоняющейся от закона Рауля: а - смесь с положительным отклонением; б - смесь с отрицательным отклонением (пунктир соответствует идеальному раствору) Коэффициенты активности характеризуют степень отклонения раствора данных жидкостей от идеальной системы. Для систем с положительным отклонением 7 > 1, для систем с отрицательным отклонением 7 < 1. Коэффициенты активности зависят от состава жидкости, ее свойств, температуры и давления в системе и вычисляются либо на основе экспериментальных данных, либо по ряду эмпирических уравнений. Уравнение изотермы жидкой фазы нормального раствора имеет вид Ра. = УаРаХ + УР(1-Х). откуда Paw-УаРа Соответственно состав равновесного пара равен в условиях равновесия р = к. Уравнение кривой равновесия фаз подобных систем записывается так же, как для идеальных [см. уравнения (11.24) - (11.26)]. Однако в этом случае коэффициент относительной летучести должен быть определен из выражения 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 [ 23 ] 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 |
||
 |
 |