
 |
|
|
Главная Переработка нефти и газа мы и составом жидкой фазы и называется изобарной температурной кривой кипения [линией кипения). Кривая ABiBB, отвечающая зависимости температуры системы от состава паровой фазы, называется изобарной кривой конденсации паров (линией конденсации или насыщенных паров). При давлении п равновесные жидкая и паровая фазы имеют одинаковую температуру и на изобарных температурных кривых равновесные составы фаз при температуре системы f, определяются точками А, и В, пересечения соответствующей горизонтали с кривыми кипения и конденсации. Горизонтальные отрезки, соединяющие точки равновесных составов жидкой и паровой фаз, называются конодами (например, А,В,). Можно отметить, что как на диаграмме изобарных температурных кривых, так и энтальпийной диаграмме (см. далее), коноды одновременно являются и изотермами. Точки, лежащие на кривой AAjAjB, отвечают жидкой фазе, находящейся при температуре кипения. Поэтому любая точка, лежащая ниже этой кривой, например точка F, характеризует систему, температура которой не достигла температуры кипения жидкости состава х,. Следовательно, область ниже кривой АА,А2В характеризует системы, состоящие только из жидкой фазы. Аналогичным образом, любая точка, лежащая выше кривой ABiBjB, например точка Е, характеризует систему, температура которой выше температуры начала конденсации паров состава /2. т.е. пары точки Е являются перегретыми и система состоит только из паровой фазы. Следовательно, область диаграммы выше кривой АВ1В2В характеризует системы, состоящие только из перегретой паровой фазы. Точки, находящиеся между изобарными температурными кривыми, например точка С, характеризуют системы, температуры которых выше температуры кипения жидкости данного состава и ниже температуры конденсации паров этого же состава, т.е. отвечают равновесным парожидкост-ным системам. Изобарные температурные кривые могут быть построены как в мольных, так и в массовых концентрациях. ЭНТАЛЬПИЙНАЯ ДИАГРАММА Для анализа и расчета процессов перегонки и ректификации используют также энтальпийные диаграммы, связывающие составы жидкой и паровой фаз с их энтальпиями. Пренебрегая теплотой растворения и считая энтальпию аддитивным свойством, можно рассчитать энтальпии жидкой и паровой фаз, имеющих равновесные составы х и у при заданных температуре t и давлении п, по следующим уравнениям: для жидкой фазы Qx + CJl-x) f = h„x + h(l-x); для насыщенных паров c.y+cji-y) hy + U-y) =H,y + H(l-y), где Q и Сц, - средние теплоемкости в интервале температур от О до t соответственно НКК и ВКК, кДж/(кг • °С); 7 и - скрытые теплоты испарения компонентов, кДж/кг; h и Н - энтальпии тех же компонентов соответственно в жидкой и паровой фазах, кДж/кг. На рис. II-10 дан общий вид энтальпийной диаграммы. На энтальпийной диаграмме приведены кривые h, энтальпии кипящей жидкости и Н, энтальпии насыщенных паров в зависимости соответственно от концентраций х и у. Любая точка F на энтальпийной диаграмме, лежащая ниже кривой энтальпии жидкой фазы, характеризует систему, состоящую только из жидкой фазы. Любая точка Е, лежащая выше кривой энтальпии паровой фазы, соответствует системе, которая состоит из перегретых паров. Точки, расположенные между кривыми энтальпий жидкой и паровой фаз, например С, характеризуют двухфазные системы. Вертикальные отрезки между кривыми энтальпий паровой и жидкой фаз отвечают скрытой теплоте испарения (конденсации) смеси определенного состава. На графиках изотерм и изобар коноды располагаются горизонтально, т.е. положение их легко определить. При температуре (, равновесные составы X, и у, определяются точками А\ и В\ (рис. II-11) Этим же составам отвечают энтальпии жидкости h, и насыщенных паров H,, определяемые ординатами точек А, и В,. Таким образом, на энтальпийной диаграмме коноды изображаются наклонными прямыми под разными углами к оси абсцисс (например, А,В,). А, Я 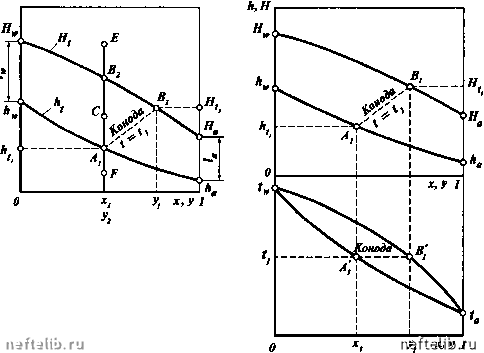 Рис. 11-16. Энтальпийная диаграмма Рис. II-11. Совмещенные энтальпийная диаграмма и изобарные температурные кривые Для удобства построений энтальпийную диаграмму обычно совмещают с графиком изобарных температурных кривых. Энтальпийные диаграммы используют при расчетах процессов перегонки и ректификации, когда необходимо знать не только материальные, но и тепловые потоки. РАСЧЕТ РАВНОВЕСНЫХ СОСТАВОВ ФАЗ ПРИ ПОМОЩИ КОНСТАНТ ФАЗОВОГО РАВНОВЕСИЯ Согласно объединенному закону Рауля и Дальтона = Ki. yj где Ki - константа фазового равновесия. Константа фазового равновесия характеризует распределение данного компонента между паровой и жидкой фазами в условиях равновесия. Для идеальной системы значение К определяется как отношение давления насыщенных паров данного компонента к давлению в системе. Однако для систем, не являющихся идеальными при повышенных давлениях и температурах, а также систем, состоящих из компонентов с существенно различающимися физико-химическими свойствами, константы фазового равновесия, вычисленные таким способом, не будут характеризовать действительного распределения компонентов между фазами. В этих случаях следует либо пользоваться экспериментально найденными величинами констант фазового равновесия, значения которых для ряда систем имеются в справочной литературе, либо вычислять К,, используя термодинамические характеристики фугитивности соответственно для жидкой и паровой 4 Фз вместо давления насыщенных паров и внешнего давления п. Тогда константу фазового равновесия рассчитывают так: Методы определения фугитивности рассматриваются в курсе химической термодинамики. С использованием констант фазового равновесия можно вычислить составы равновесных жидкой и паровой фаз бинарной смеси при заданных температуре и давлении. Поскольку X = (11.29) то из уравнений (11.20) и (11.23) получим и у = К„х-Л- 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 [ 22 ] 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 |
||
 |
 |